verschillende wit-rode laesies treden op in het orale mucosa, waaronder leukoplakia, erythroplakia, candidiasis, geografische tong, lichen planus, lichenoïde laesies, en anderen. Orale leukoplakia en orale erythroplakia zijn bekend prekankerletsels, terwijl het kwaadaardige potentieel van orale lichen planus (OLP) en/of orallichenoïde laesies (OLLs) is het onderwerp geweest van veel discussie in de afgelopen decennia., Aangezien de klinische en histologische kenmerken van deze wit-en-rode laesies vergelijkbaar zijn, is differentiële diagnose van hen belangrijk. Oral lichen planus heeft een karakteristieke bilaterale verdeling, meestal met betrekking tot de buccale mucosa, dorsum en ventrale oppervlakken van de tong en/of gingiva, wanneer het vaak presenteert als desquamatieve gingivitis.1,2 palatale en labiale betrokkenheid is ongebruikelijk. Het is vaak asymptomatisch, hoewel wanneer er gebieden van ulceratie, de patiënt ervaart verschillende graden van ongemak, verergerd door het eten van kruidig of zuur voedsel.,
Er zijn vele antigeenspecifieke mechanismen die betrokken kunnen zijn bij de pathogenese van OLP, waaronder MHC – klasse I-en MHC-klasse II-beperkte antigeenpresentatie door lesional keratinocyten, activering van antigeenspecifieke CD4+ helper T-cellen en CD8+ cytotoxische T-cellen, clonale expansie van antigeenspecifieke T-cellen en keratinocyte apoptose veroorzaakt door antigeenspecifieke CD8+ cytotoxische T-cellen.,roteins (hsp ‘ s), reactieve zuurstof species (ROS), stress, mast-cel chemotaxis en degranulatie gestimuleerd door de T-cel RANTES, endotheliale cel adhesie molecuul expressie gestimuleerd door de mestcel TNF-a, T-cel MMP-9 activering door mast-cel chymase, epitheliale basaalmembraan verstoring door mast-cel proteasen of T-cel-MMP-9, keratinocyten apoptose veroorzaakt door epitheliale basaalmembraan verstoring van de intra-epitheliale CD8+ T-cel migratie door middel van basement membraan breekt, inflammatoire cel overleving verlengd door T-cel RANTES en niet-specifieke T-cel werving door keratinocyten-afgeleide chemokines.,5,6


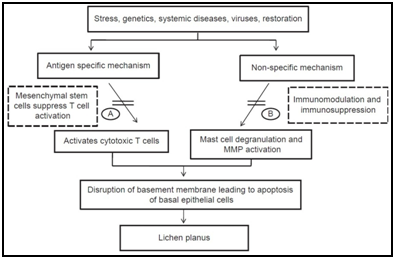
OLP kan worden onderverdeeld in zes typen (reticulaire, papule, plaque, atrofische, erosieve en bulleuze typen), of twee typen, wit en rood, terwijl het meestal wordt ingedeeld in drie typen, reticulaire, atrofische en erosieve. Laesies zijn niet homogeen en sommige gevallen kunnen zich voordoen als een mengsel van deze klinische subtypes., De Wereldgezondheidsorganisatie (WHO) ontwierp in 1978 een reeks diagnostische criteria voor OLP, die in 2003 werd herzien. De gewijzigde who-diagnostische criteria omvatten differentiatie tussen OLP en OLLs.7,8 in deze gewijzigde WHO-criteria wordt het essentiële klinische kenmerk van OLP gedefinieerd als de aanwezigheid van bilaterale laesies die een kantachtig netwerk van witte lijnen vertonen(reticulair patroon), maar niet van plaque, atrofische, erosieve en bulleuze laesies. Wanneer de bilaterale reticulaire laesie afwezig is, wordt het aangeduid als “klinisch compatibel met OLP”.,
biopsie en histopathologisch onderzoek van aangetaste weefsels kan nodig zijn om andere ziekten die orale lichen planus kunnen nabootsen uit te sluiten , bijvoorbeeld discoïde lupus erythematosus en om mogelijke epitheliale dysplasie te identificeren. De noodzaak van biopsie in alle gevallen van vermoedelijke lichen planus wordt besproken, maar het zou passend zijn in gevallen die atypisch in presentatie, atrofisch of ulcerating zijn. Huidtesten op allergie voor kwikamalgaam kunnen worden uitgevoerd wanneer er een vermoeden bestaat dat er een korstmossenreactie kan zijn als reactie op dit tandheelkundig materiaal., Er is echter discussie over de waarde van een dergelijk onderzoek. De histopathologie van OLP werd voor het eerst beschreven door Dubreuill in 1906, en in 1972 werd het herzien door Shklar die drie karakteristieke kenmerken beschreef: bovenliggende keratinisatie, liquefactiedegeneratie van de basale cellaag en een dichte subepitheliale band van lymfocyten.
een van de belangrijkste kwesties met betrekking tot OLP is het potentieel voor maligne transformatie in OSCC., Hoewel de WHO OLP heeft gecategoriseerd als een precancereuze aandoening, blijft het risico van kwaadaardige transformatie van OLP een onderwerp van debat in de literatuur. Het is onzeker welke mechanismen maligne transvorming van OLP kunnen veroorzaken. De preferentiële plaatsen van mondeling Squammeus celcarcinoom (OSCC) die zich van OLP laesies ontwikkelt zijn de tong en buccale mucosa, en de weerslag is hoger in de eerste dan de laatste, terwijl epitheliaale dysplasie in OLP vaker voorkomt in de buccale mucosa.,
Het doel van de behandeling van symptomatisch oraal lichen planus is het genezen van gebieden met pijnlijke ulceratie of blaarvorming. Er moet een stapsgewijze aanpak worden gevolgd. Topische corticosteroïd therapie is de steunpilaar van de behandeling voor ulceratieve ziekte. Er is beperkt bewijs uit gerandomiseerde gecontroleerde studies over de precieze werkzaamheid van de verschillende preparaten die algemeen worden gebruikt., Als aanvulling op de therapie, moeten patiënten ook worden geadviseerd over de noodzaak om een hoge standaard van mondhygiëne te handhaven en alle oorzaken van mucosale trauma, zoals slecht passend kunstgebit, scherpe cuspen en slechte tandheelkundige restauraties moeten worden geëlimineerd. Patiënten dienen geïnformeerd te worden dat er een zeer klein risico bestaat op maligniteit geassocieerd met orale lichen planus en dat langdurige monitoring aangewezen is.In ons geval toonde methodisch en systematisch gebruik van Tacrolimus (immunomodulator) een drastische verbetering in de volledige genezing van de aanhoudende laesies., Tacrolimus is een macrolide calcineurineremmer. Calcineurine is een calcium-en calmoduline-afhankelijke serine / threonine-eiwitfosfatase die de T-cellen van het immuunsysteem activeert. Wanneer de activering van de T-celreceptor voorkomt, is er verhoging van intracellular calcium die in aanwezigheid van calmoduline als katalysator calcineurine activeert. Deze stap wordt gevolgd door “de phosphorylation” die de beweging van transcriptiefactor van nucleaire factor van geactiveerde cellen van T aan de kern van cel van t stimuleert, waardoor de activiteit van genen die voor IL-2 en andere cytokines coderen toeneemt., Dit is gevonden om één van de mechanismen resulterend in OLP zoals letsels te zijn. In dit ziektemechanisme werkt TACROLIMUS in het defosforyleringsstadium (Figuur 6), waardoor het de fosforylering belemmert en fosforylering teweegbrengt. Dit vermindert uiteindelijk de activiteit van genen die voor diverse ILs coderen die de vooruitgang naar OLP zoals letsels ophoudt. Dit is hieronder afgebeeld.11,12
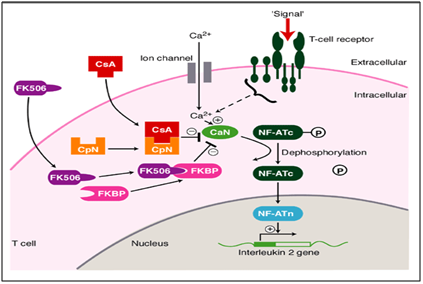
Figuur 6 werkingsmechanisme van tacrolimus als een immunomodulator bij de behandeling van orale erosieve lichen planus.,
in diverse studies is topische Tacrolimus werkzaam gebleken bij de behandeling van OLP en sommige hebben ook een betere initiële therapeutische respons gemeld dan andere geneesmiddelen, waaronder de corticosteroïden. Studies ter evaluatie van de werkzaamheid van topische Tacrolimus in de Indiase populatie, vooral over lange periodes, zijn echter schaars. Tacrolimus (0,1% g / v) is door verschillende onderzoekers effectief en veilig gemeld voor de behandeling van OLP., Het bleek een effectief middel te zijn om de symptomen en tekenen van erosieve of ulceratieve orale lichen planus onder controle te houden en had geen noemenswaardige bijwerkingen gedurende een gemiddelde toepassingsduur van 19,8 maanden.13 in a meta analysis by Chamani G et al., 14 geconcludeerd werd dat topische Tacrolimus een effectief alternatief is voor diverse corticosteroïden en beschouwd kan worden als een eerstelijnstherapie bij de behandeling van OLEP.