Varie lesioni bianco-e-rosso si verificano nella mucosa orale, tra cui leucoplachia, eritroplachia, candidosi, lingua geografica, lichen planus, lesioni lichenoidi, e altri. Leucoplachia orale e eritroplachia orale sono ben noti per essere lesioni precancerose, mentre il potenziale maligno del lichen planus orale (OLP) e/o lesioni orallichenoidi (Os) è stato oggetto di molte discussioni negli ultimi decenni., Poiché le caratteristiche cliniche e istologiche di queste lesioni bianche e rosse sono simili, la diagnosi differenziale di esse è importante. Il lichen planus orale ha una distribuzione tipicamente bilaterale, che coinvolge tipicamente la mucosa buccale, il dorso e le superfici ventrali della lingua e / o della gengiva, quando spesso si presenta come gengivite desquamativa.1,2 Il coinvolgimento palatale e labiale è insolito. È spesso asintomatico, anche se quando ci sono aree di ulcerazione, il paziente sperimenta vari gradi di disagio, esacerbati mangiando cibi piccanti o acidi.,
Ci sono molti meccanismi antigene-specifici possono essere coinvolti nella patogenesi di OLP, tra cui MHC classe I – e MHC classe II-limitata presentazione dell’antigene da cheratinociti lesionali, attivazione di antigene-specifici CD4+ helper T-cellule e CD8+ citotossici T-cellule, espansione clonale di antigene-specifici T-cellule, e apoptosi cheratinociti innescato da antigene-specifici CD8+ citotossici T-cellule.,roteins (Hsp), specie reattive dell’ossigeno (ROS), lo stress, i mastociti la chemiotassi e la degranulazione stimolato da cellule T RANTES, delle cellule endoteliali espressione della molecola di adesione stimolato dai mastociti TNF-a, T-cell attivazione di MMP-9 da parte di mastociti chymase, membrana basale epiteliale disservizi da parte di mastociti proteasi o della T-cellula di MMP-9, l’apoptosi dei cheratinociti innescato dalla membrana basale epiteliale interruzione, intra-epiteliali cellule CD8+ T-migrazione attraverso la membrana basale si rompe, di cellule infiammatorie sopravvivenza prolungata di cellule T RANTES e non di cellule T specifiche per il reclutamento da parte dei cheratinociti derivati chemochine.,5,6


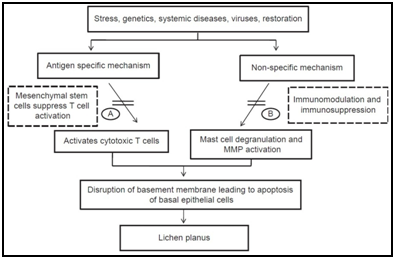
Figura 5 Varie etiopathogenic percorsi proposti per il lichen planus orale sulla base di vari studi.
OLP può essere diviso in sei tipi (reticolare, papule, placca, atrofica, erosiva e tipi bollosi), o due tipi, bianco e rosso, mentre è più comunemente classificato in tre tipi, reticolare, atrofica ed erosiva. Le lesioni non sono omogenee e alcuni casi possono presentarsi come una miscela di questi sottotipi clinici., L’Organizzazione Mondiale della Sanità (OMS) ha ideato una serie di criteri diagnostici per OLP nel 1978 che è stata rivista nel 2003. I criteri diagnostici modificati dell’OMS implicano la differenziazione tra OLP eLLs.7,8 In questi criteri OMS modificati, la caratteristica clinica essenziale dell’OLP è definita come la presenza di lesioni bilaterali che presentano una rete di linee bianche simile a un pizzo(pattern reticolare), ma non di lesioni a placche, atrofiche, erosive e bollose. Quando la lesione reticolare bilaterale è assente, allora, è designata come “clinicamente compatibile con OLP”.,
La biopsia e l’esame istopatologico del tessuto interessato possono essere necessari per escludere altre malattie che possono imitare il lichen planus orale , ad esempio il lupus eritematoso discoide e per identificare una possibile displasia epiteliale. La necessità di biopsia in tutti i casi di sospetto lichen planus è dibattuta, ma sarebbe opportuno nei casi che sono atipici nella presentazione, atrofica o ulcerosa. Il test cutaneo per l’allergia all’amalgama di mercurio può essere effettuato laddove si sospetti che possa esserci una reazione lichenoide in risposta a questo materiale dentale., Tuttavia c’è un dibattito sul valore di tale indagine. L’istopatologia dell’OLP fu descritta per la prima volta da Dubreuill nel 1906 e nel 1972 fu rivista da Shklar che descrisse tre caratteristiche: cheratinizzazione sovrastante, degenerazione della liquefazione dello strato delle cellule basali e una densa banda subepiteliale di linfociti.
Una delle questioni più importanti riguardanti OLP è il suo potenziale di trasformazione maligna in OSCC., Sebbene l’OMS abbia classificato l’OLP come una condizione precancerosa, il rischio di trasformazione maligna dell’OLP rimane oggetto di dibattito in letteratura. Non è chiaro quali meccanismi possano causare la trans – formazione maligna di OLP. I siti preferenziali di carcinoma a cellule squammose orali (OSCC) che si sviluppa da lesioni OLP sono la lingua e mucosa buccale, e l’incidenza è maggiore nel primo rispetto al secondo, mentre displasia epiteliale in OLP è più prevalente nella mucosa buccale.,9
Gli obiettivi del trattamento del lichen planus orale sintomatico sono di guarire aree di ulcerazione dolorosa o vesciche. Occorre adottare un approccio graduale. La terapia attuale del corticosteroide è il pilastro del trattamento per la malattia ulcerosa. Esistono prove limitate da studi randomizzati controllati sull’efficacia precisa dei vari preparati che sono di uso comune., In aggiunta alla terapia, i pazienti devono anche essere informati della necessità di mantenere un elevato standard di igiene orale e qualsiasi causa di trauma della mucosa come protesi mal adattate, cuspidi affilate e restauri dentali scadenti deve essere eliminata. I pazienti devono essere informati che esiste un rischio molto ridotto di neoplasie associate al lichen planus orale e che il monitoraggio a lungo termine è appropriato.10
Nel nostro caso, l’uso metodico e sistematico di Tacrolimus (immunomodulatore) ha mostrato un drastico miglioramento nella guarigione delle lesioni persistenti completamente., Tacrolimus è un inibitore della calcineurina macrolide. Calcineurin è un calcio e calmodulina dipendente serina/proteina treonina fosfatasi che attiva le cellule T del sistema immunitario. Quando l’attivazione di recettore di cella di T succede, c’è aumento del calcio intracellulare che alla presenza di calmodulin come un catalizzatore attiva calcineurin. Questo passaggio è seguito da “de fosforilazione” che stimola il movimento del fattore di trascrizione del fattore nucleare delle cellule T attivate al nucleo della cellula T, aumentando così l’attività dei geni che codificano per IL-2 e altre citochine., Questo è stato trovato per essere uno dei meccanismi con conseguente OLP come lesioni. In questo meccanismo di malattia, il TACROLIMUS agisce allo stadio di defosforilazione (Figura 6) ostacolandolo e determinando la fosforilazione. Ciò infine diminuisce l’attività dei geni che codificano per i vari ILs che cessa il progresso verso OLP come le lesioni. Questo è stato rappresentato in modo pittorico di seguito.11,12
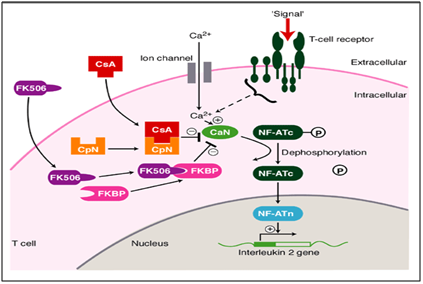
Figura 6 Meccanismo d’azione di tacrolimus come immunomodulatore nel trattamento del lichen planus erosivo orale.,
Vari studi hanno dimostrato che Tacrolimus topico è efficace nel trattamento dell’OLP e alcuni hanno anche riportato una migliore risposta terapeutica iniziale rispetto ad altri farmaci, inclusi i corticosteroidi. Ma gli studi che valutano l’efficacia di Tacrolimus topico nella popolazione indiana, specialmente per lunghi periodi, sono scarsi. Tacrolimus (0,1% p/v) è stato segnalato come efficace e sicuro per il trattamento della OLP da vari ricercatori., E ‘ stato trovato per essere un mezzo efficace per controllare i sintomi e segni di erosiva o ulcerosa orale lichen planus e non ha avuto effetti avversi notevoli per una durata media di applicazione di 19,8 mesi.13 In una meta analisi di Chamani G et al., 14 è stato concluso che Tacrolimus attuale è un’alternativa efficace a vari corticosteroidi e può essere considerato come terapia di prima linea nella gestione di OLEP.