Různé bílé a červené léze se vyskytují v ústní sliznici, včetně leukoplakie, erythroplasia, kandidóza, geografické jazyk, lichen planus, lichenoidní léze, a další. Orální leukoplakie a ústní erythroplasia jsou dobře známo, že je prekancerózní léze, zatímco maligní potenciál orální lichen planus (OLP) a/nebo orallichenoid léze (OLLs) byla předmětem velké diskuse v posledních několika desetiletích., Vzhledem k tomu, že klinické a histologické rysy těchto bílo-červených lézí jsou podobné, je důležitá jejich diferenciální diagnostika. Orální lichen planus má charakteristicky bilaterální distribuce, typicky zahrnující bukální sliznice, hřbet a ventrální plochy jazyka a/nebo dásně, když to často prezentuje jako deskvamativní gingivitida.1,2 palatální a labiální postižení je neobvyklé. Často je asymptomatická, i když existují oblasti ulcerace, pacient zažívá různé stupně nepohodlí, zhoršené konzumací kořeněných nebo kyselých potravin.,
Existuje mnoho antigen-specifické mechanismy mohou být zapojeny do patogeneze OLP, včetně MHC třídy I a MHC II. třídy-omezené antigen prezentace lesional keratinocyty, aktivace antigen-specifických CD4+ pomocné T-lymfocyty a CD8+ cytotoxické T-buňky, klonální expanzi antigen-specifických T-buněk a apoptózy keratinocytů vyvolané antigen-specifických CD8+ cytotoxické T-buňky.,roteins (HSPs), reaktivních forem kyslíku (ROS), stres, chemotaxi žírných buněk a degranulace stimulovány T-buněk RANTES, endoteliální buňky adhezní molekuly výraz stimulován žírných buněk TNF-a, T-buňky, MMP-9 aktivace žírných buněk chymase, epiteliální bazální membrány narušení z žírných buněk proteázy nebo T-buněk, MMP-9, apoptózy keratinocytů vyvolané epiteliální bazální membrány narušení, intra-epiteliální CD8+ T-buněčnou migraci prostřednictvím bazální membrány přestávky, zánětlivé buňky přežití delší o T-buňky, RANTES a non-specifické T-buňky náboru do keratinocytů-derived chemokines.,5,6


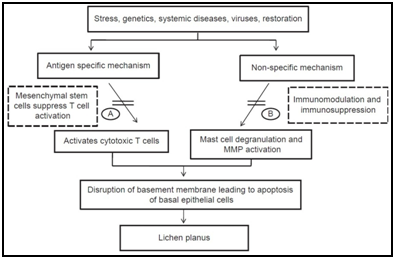
Obrázek 5 Různých etiopathogenic cesty navrhované pro orální lichen planus na základě různých studií.
OLP lze rozdělit do šesti typů (retikulární, papule, plaky, atrofické, erozivní, a bulózní typy), nebo dva druhy, bílé a červené, zatímco to je nejčastěji klasifikována do tří typů, retikulární, atrofické, erozivní. Léze nejsou homogenní a některé případy mohou být přítomny jako směs těchto klinických podtypů., Světová zdravotnická organizace (WHO) navrhla soubor diagnostických kritérií pro OLP v roce 1978, která byla revidována v roce 2003. Modifikovaná diagnostická kritéria WHO zahrnují diferenciaci mezi OLP a Oll.7,8 V těchto modifikovaných kritérií WHO, základní klinické funkce OLP je definován jako přítomnost bilaterální léze, které vykazují krajka-jako síť bílých čar(retikulární vzor), ale ne plaku, atrofické, erozivní, a bulózní léze. Pokud bilaterální retikulární léze chybí, je označena jako „klinicky kompatibilní s OLP“.,
Biopsii a histopatologické vyšetření postižené tkáně, může být nutné vyloučit jiné nemoci, které mohou napodobovat orální lichen planus , na příklad diskoidní lupus erythematodes a identifikovat možné epiteliální dysplazie. Potřebu biopsie ve všech případech podezření na lichen planus je diskutována, ale bylo by vhodné v případech, které jsou atypické v prezentaci, atrofické, ulcerovaný. Kožní test na alergii na rtuťový amalgám může být proveden tam, kde existuje podezření, že v reakci na tento zubní materiál může dojít k lichenoidní reakci., Existuje však debata o hodnotě takového šetření. Histopatologické vyšetření z OLP byl poprvé popsán Dubreuill v roce 1906, a v roce 1972, to byl revidován Shklar, který popsal tři charakteristické rysy: nad keratinizace, zkapalňování degenerace bazální vrstva buněk a husté subepiteliální kapela lymfocytů.
jednou z nejdůležitějších otázek týkajících se OLP je její potenciál pro maligní transformaci na OSCC., Ačkoli WHO klasifikovala OLP jako prekancerózní stav, riziko maligní transformace OLP zůstává předmětem debaty v literatuře. Není jisté, jaké mechanismy by mohly způsobit maligní trans-tvorbu OLP. Preferenční lokality Ústní Squammous Karcinomu (OSCC), který se vyvíjí z OLP léze jsou jazyk a bukální sliznice, a incidence je vyšší v bývalý než latter, zatímco epiteliální dysplazie v OLP je více převládající v bukální sliznici.,9
cílem léčby symptomatického perorálního lichen planus je léčit oblasti bolestivé ulcerace nebo puchýřů. Měl by být přijat postupný přístup. Topická terapie kortikosteroidy je základem léčby ulcerózních onemocnění. Z randomizovaných kontrolovaných studií existují omezené důkazy o přesné účinnosti různých přípravků, které se běžně používají., Jako doplněk k terapii, pacienti by také měli být poučeni o nutnosti zachovávat vysokou úroveň ústní hygieny a jakékoli příčiny slizniční trauma jako špatně padnoucí zubní protézy, ostré hrbolky a špatné zubní výplně by měly být odstraněny. Pacienti by měli být informováni, že existuje velmi malé riziko malignity spojené s perorálním lichen planus a že je vhodné dlouhodobé sledování.10
v našem případě metodické a systematické používání takrolimu (imunomodulátoru) ukázalo drastické zlepšení hojení přetrvávajících lézí úplně., Takrolimus je inhibitor makrolidového kalcineurinu. Kalcineurinu je kalcium a kalmodulin dependentní serin/threonin protein fosfatázy, který aktivuje T-buňky imunitního systému. Při aktivaci T buněk receptor se vyskytuje, tam je zvýšení intracelulárního vápníku, které v přítomnosti kalmodulin jako katalyzátor aktivuje kalcineurinu. Tento krok je následován „de fosforylace“, která stimuluje pohyb Transkripční faktor Nukleární faktor aktivovaných T-buněk se jádro T-buněk, čímž se zvyšuje aktivitu genů kódující IL-2 a dalších cytokinů., Bylo zjištěno, že se jedná o jeden z mechanismů, které vedou k poškození podobným OLP. V tomto mechanismu onemocnění působí takrolimus ve fázi defosforylace (obrázek 6), čímž jej brání a způsobuje fosforylaci. To nakonec snižuje aktivitu genů kódujících různé ILs, které zastavují pokrok směrem k lézím podobným OLP. To bylo pictorially zastoupeny níže.11,12
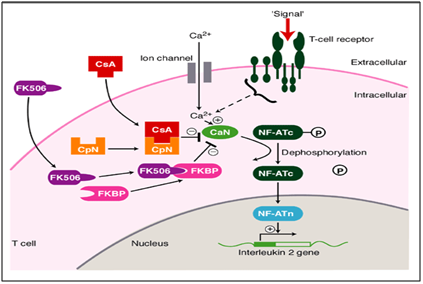
Obrázek 6 Mechanismus působení takrolimu jako imunomodulátor při léčbě ústní erozivní lichen planus.,
různé studie zjistily, že lokální takrolimus je účinný při léčbě OLP, a některé také hlásily lepší počáteční terapeutickou odpověď než jiné léky včetně kortikosteroidů. Studie hodnotící účinnost topického takrolimu u indické populace, zejména po dlouhou dobu, jsou však vzácné. Bylo hlášeno, že takrolimus (0, 1% w/V) je účinný a bezpečný pro léčbu OLP různými vyšetřovateli., Bylo zjištěno být účinný prostředek, jak kontrolovat symptomy a příznaky erozivní nebo ulcerózní orální lichen planus a neměl žádné závažné nepříznivé účinky po dobu aplikace 19,8 měsíců.13 V metaanalýze Chamani G et al.,14 byl učiněn závěr, že topický takrolimus je účinným náhradníkem různých kortikosteroidů a může být považován za terapii první linie při léčbě OLEP.