w błonie śluzowej jamy ustnej występują różne biało-czerwone zmiany, w tym leukoplakia, erythroplakia, kandydoza, język geograficzny, liszaj płaski, zmiany liszajowate i inne. Oral leukoplakia i oral erythroplakia są dobrze znane jako zmiany przedrakowe, podczas gdy złośliwy potencjał liszaj płaski jamy ustnej (OLP) i / lub orallichenoid zmian (OLLs) był przedmiotem wielu dyskusji w ciągu ostatnich kilku dekad., Ponieważ cechy kliniczne i histologiczne tych biało-czerwonych zmian są podobne, ważna jest ich diagnostyka różnicowa. Liszaj ustny ma charakterystyczny rozkład obustronny, Zwykle obejmujący błonę śluzową jamy ustnej, grzbietową i brzuszną powierzchnię języka i / lub dziąseł, gdy często występuje jako złuszczające zapalenie dziąseł.1200 mm Jest to często bezobjawowe, chociaż gdy są obszary owrzodzenia, pacjent doświadcza różnego stopnia dyskomfortu, pogarsza się przez jedzenie pikantne lub kwaśne pokarmy.,
istnieje wiele mechanizmów specyficznych dla antygenu, w tym prezentacja antygenu MHC klasy I i MHC klasy II ograniczonego przez lesionalne keratynocyty, aktywacja limfocytów T pomocniczych specyficznych dla antygenu CD4+ i cytotoksycznych limfocytów T CD8+, ekspansja klonalna limfocytów T specyficznych dla antygenu oraz apoptoza keratynocytów wywołana przez cytotoksyczne limfocyty T specyficznych dla antygenu CD8+.,roteiny (HSPs), reaktywne formy tlenu (ROS), stres, chemotaksja komórek tucznych i degranulacja stymulowana przez RANTES komórek T, ekspresja cząsteczki adhezji komórek śródbłonka stymulowana przez TNF-a komórek tucznych, aktywacja komórek T MMP-9 przez chymazę komórek tucznych, zakłócenie błony podstawnej nabłonka przez proteazy komórek tucznych lub MMP-9, apoptoza keratynocytów wywołana przez zakłócenie błony podstawnej nabłonka, migracja komórek T CD8+ przez pęknięcia błony podstawnej, przedłużone przeżycie komórek zapalnych przez Rantes komórek T i nieswoistej rekrutacji komórek T przez chemokiny pochodzące z keratynocytów.,5,6


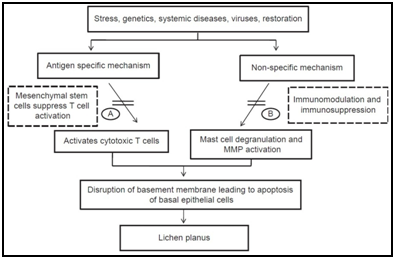
Rysunek 5 różne drogi etiopatogenne zaproponowane dla liszaj płaski w jamie ustnej na podstawie różnych badań.
OLP można podzielić na sześć typów (siatkowe, grudki, płytki nazębne, atroficzne, erozyjne i pęcherzowe typy) lub dwa typy, biały i czerwony, podczas gdy jest najczęściej klasyfikowany do trzech typów, siatkowe, atroficzne i erozyjne. Zmiany chorobowe nie są jednorodne i w niektórych przypadkach mogą występować jako mieszanina tych podtypów klinicznych., Światowa Organizacja Zdrowia (WHO) opracowała w 1978 roku zestaw kryteriów diagnostycznych OLP, który został zmieniony w 2003 roku. Zmodyfikowane kryteria diagnostyczne WHO obejmują rozróżnienie OLP i OLLs.7,8 w tych zmodyfikowanych kryteriach WHO podstawową cechą kliniczną OLP jest obecność zmian obustronnych, które wykazują koronkową sieć białych linii (wzór siateczkowy), ale nie zmian blaszkowych, zanikowych, nadżerkowych i pęcherzowych. Gdy obustronna zmiana Siateczkowa jest nieobecna, jest oznaczona jako „klinicznie zgodna z OLP”.,
biopsja i badanie histopatologiczne dotkniętej tkanki mogą być potrzebne do wykluczenia innych chorób , które mogą naśladować liszaj płaski jamy ustnej, na przykład dyskoidalny toczeń rumieniowaty i zidentyfikować ewentualną dysplazję nabłonkową. Konieczność wykonania biopsji we wszystkich przypadkach podejrzenia liszaj płaski jest dyskusyjna, ale byłoby to właściwe w przypadkach nietypowych w prezentacji, zanikowych lub owrzodzenia. Testy skórne na alergię na amalgamat rtęci mogą być podejmowane, gdy istnieje podejrzenie, że może wystąpić reakcja lichenoidowa w odpowiedzi na ten Materiał dentystyczny., Istnieje jednak debata na temat wartości takiego dochodzenia. Histopatologia OLP została po raz pierwszy opisana przez Dubreuilla w 1906 roku, a w 1972 roku została zrewidowana przez Shklara, który opisał trzy charakterystyczne cechy: pokrywającą się keratynizację, degenerację upłynniającą warstwy podstawnej komórki i gęste pasmo podepitelialne limfocytów.
jednym z najważniejszych zagadnień dotyczących OLP jest jego potencjał do złośliwej transformacji w OSCC., Chociaż WHO sklasyfikowała OLP jako stan przedrakowy, ryzyko złośliwej transformacji OLP pozostaje przedmiotem debaty w literaturze. Nie jest pewne, jakie mechanizmy mogą powodować złośliwe trans-formowanie OLP. Preferencyjne miejsca raka Płucokomórkowego jamy ustnej (OSCC), który rozwija się ze zmian OLP są język i błony śluzowej jamy ustnej, a częstość występowania jest wyższa w pierwszym niż w drugim, podczas gdy dysplazja nabłonkowa w OLP jest bardziej rozpowszechniona w błonie śluzowej jamy ustnej.,9
celem leczenia objawowego liszaj płaski jamy ustnej jest leczenie bolesnych owrzodzeń lub pęcherzy. Należy przyjąć podejście stopniowe. Miejscowe leczenie kortykosteroidami jest podstawą leczenia choroby wrzodziejącej. Istnieją ograniczone dowody z randomizowanych kontrolowanych badań co do dokładnej skuteczności różnych preparatów, które są powszechnie stosowane., Jako uzupełnienie terapii należy również poinformować pacjentów o konieczności utrzymania wysokiego standardu higieny jamy ustnej i wyeliminować wszelkie przyczyny urazów błony śluzowej, takie jak źle dopasowana proteza zębowa, ostre guzki i słabe uzupełnienia zębów. Należy poinformować pacjentów, że ryzyko wystąpienia nowotworu złośliwego związanego z liszaj płaski jamy ustnej jest bardzo małe i że należy prowadzić długoterminową obserwację.10
w naszym przypadku metodyczne i systematyczne stosowanie takrolimusu (immunomodulatora) wykazało drastyczną poprawę w gojeniu utrzymujących się zmian całkowicie., Takrolimus jest inhibitorem makrolidowej kalcyneuryny. Kalcyneuryna jest zależną od wapnia i kalmoduliny fosfatazą białkową serynowo-treoninową, która aktywuje komórki T układu odpornościowego. Gdy dochodzi do aktywacji receptora limfocytów T, dochodzi do wzrostu wewnątrzkomórkowego wapnia, który w obecności kalmoduliny jako katalizatora aktywuje kalcyneurynę. Po tym etapie następuje „fosforylacja de”, która stymuluje ruch czynnika transkrypcyjnego czynnika jądrowego aktywowanych komórek T do jądra komórki T, zwiększając w ten sposób aktywność genów kodujących IL-2 i inne cytokiny., Stwierdzono, że jest to jeden z mechanizmów powodujących zmiany podobne do OLP. W tym mechanizmie chorobowym takrolimus działa na etapie defosforylacji (ryc. To ostatecznie zmniejsza aktywność genów kodujących dla różnych ILs, co przerywa postęp w kierunku zmian podobnych do OLP. Zostało to obrazowo przedstawione poniżej.11,12
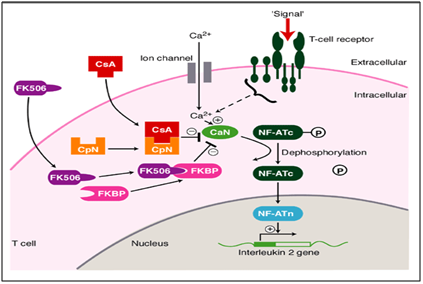
rycina 6 mechanizm działania takrolimusu jako immunomodulatora w leczeniu doustnych porostów nadżerkowych.,
w różnych badaniach stwierdzono, że takrolimus stosowany miejscowo jest skuteczny w leczeniu OLP, a niektóre z nich wykazały lepszą początkową odpowiedź terapeutyczną niż inne leki, w tym kortykosteroidy. Jednak badania oceniające skuteczność miejscowego stosowania takrolimusu w populacji Indian, szczególnie w długim okresie, są rzadkie. Niektórzy badacze donoszą, że takrolimus (0,1% M/v) jest skuteczny i bezpieczny w leczeniu OLP., Stwierdzono, że jest skutecznym sposobem kontrolowania objawów i objawów nadżerki lub wrzodziejącego porostu jamy ustnej planus i nie miał zauważalnych działań niepożądanych w średnim okresie stosowania wynoszącym 19,8 miesiąca.13 w metaanalizie Chamani G et al.Stwierdzono, że miejscowo takrolimus jest skutecznym alternatywą dla różnych kortykosteroidów i może być uważany za leczenie pierwszego rzutu w leczeniu OLEP.