a Különböző fehér-piros elváltozások előfordulhatnak a szájnyálkahártya, beleértve a leukoplakia, erythroplakia, candidiasis, földrajzi nyelv, zuzmó planus, lichenoid elváltozások, vagy mások. Az orális leukoplakia és az orális erythroplakia jól ismert prekancerózus léziók, míg az orális lichen planus (OLP) és/vagy orallichenoid léziók (OLLs) rosszindulatú potenciálja az elmúlt néhány évtizedben sok vita tárgyát képezte., Mivel ezeknek a fehér-vörös elváltozásoknak a klinikai és szövettani jellemzői hasonlóak, ezek differenciáldiagnózisa fontos. Az orális zuzmó planus jellegzetesen kétoldalú eloszlású, jellemzően a szájnyálkahártya, a Dorsum és a ventrális felületek a nyelv és/vagy az íny, amikor gyakran jelenik meg, mint desquamative gingivitis.1,2 a palatális és labiális beavatkozás szokatlan. Gyakran tünetmentes, bár ha vannak fekélyek, a beteg különböző mértékű kényelmetlenséget tapasztal, amelyet fűszeres vagy savas ételek fogyasztása súlyosbít.,
sok antigén-specifikus mechanizmusok is be lehet vonni a patogenezisében OLP, beleértve az MHC i. osztály -, illetve MHC class II-korlátozott antigén prezentáció által lesional hámsejtek, aktiválása antigén-specifikus CD4+ helper T-sejtek, illetve CD8+ citotoxikus T-sejtek klonális bővítése antigén-specifikus T-sejtek, valamint nem kivitelezhető apoptózist kiváltó antigén-specifikus CD8+ citotoxikus T-sejtek.,roteins (hsp-k), a reaktív oxigén fajták (ROS), a stressz, a hízósejt chemotaxis, valamint degranulation serkenti a T-sejt RANTES, endothel sejt adhéziós molekula kifejezés ösztönözte a hízósejtek TNF-a, a T-sejt MMP-9 aktiváció által hízósejt chymase, epithelialis pince membrán zavar által hízósejt proteázok, vagy T-sejt MMP-9-et, nem kivitelezhető által kiváltott apoptózis epithelialis pince membrán zavar, intra-epithelialis CD8+ T-sejtek migrációját keresztül pince membrán megszegi, gyulladásos sejt túlélését hosszan tartó által a T-sejt RANTES, mind a nem-specifikus T-sejt toborzás által nem kivitelezhető eredetű chemokines.,5,6

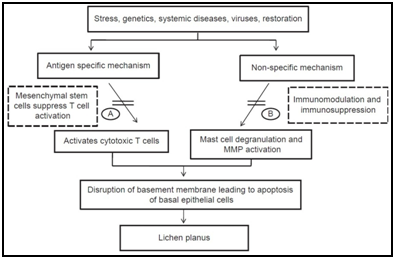
5.ábra különböző etiopathogenikus utak javasolt orális lichen planus különböző vizsgálatok alapján.
az OLP hat típusra osztható (retikuláris, papulus, plakk, atrófiás, eróziós és bullous típusok), vagy két típusra, fehérre és pirosra, míg leggyakrabban három típusba sorolják, retikuláris, atrófiás és erozív. A léziók nem homogének, és egyes esetekben e klinikai altípusok keverékeként jelenhetnek meg., Az Egészségügyi Világszervezet (WHO) 1978-ban kidolgozott egy sor diagnosztikai kritériumot az OLP-re, amelyet 2003-ban felülvizsgáltak. A módosított WHO diagnosztikai kritériumok közé tartozik az OLP és az Oll-ek megkülönböztetése.7,8 ezekben a módosított WHO kritériumokban az OLP alapvető klinikai jellemzője olyan kétoldalú elváltozások jelenléte, amelyek fehér vonalak csipkeszerű hálózatát mutatják(retikuláris minta), de nem plakk, atrófiás, eróziós és bullous léziók. Ha a kétoldalú retikuláris elváltozás hiányzik, akkor “klinikailag kompatibilis az OLP-vel”.,
az érintett szövet biopsziájára és kórszövettani vizsgálatára lehet szükség a szájüregi lichen planust utánzó egyéb betegségek , például a discoid lupus erythematosus kizárásához és a lehetséges epithelialis dysplasia azonosításához. A biopszia szükségességét minden gyanús zuzmó planus esetében vitatják, de helyénvaló lenne olyan esetekben, amelyek atipikusak, atrofikusak vagy fekélyesek. A higany amalgámmal szembeni allergia bőrvizsgálatát akkor lehet elvégezni, ha fennáll annak a gyanúja, hogy erre a fogászati anyagra válaszul lichenoid reakció léphet fel., Vita van azonban egy ilyen vizsgálat értékéről. A kórszövettani OLP először írta le Dubreuill 1906-ban, majd 1972-ben felülvizsgálta Shklar, aki leírt három jellemző tulajdonságok: fedő elszarusodása, cseppfolyósítása degeneráció a bazális sejtes réteg pedig egy sűrű subepithelial zenekar a limfociták.
az OLP-vel kapcsolatos egyik legfontosabb kérdés az OSCC-be való rosszindulatú átalakulás lehetősége., Bár a WHO az OLP-t precancerus állapotnak minősítette, az OLP rosszindulatú átalakulásának kockázata továbbra is vita tárgyát képezi a szakirodalomban. Nem biztos, hogy milyen mechanizmusok okozhatják az OLP rosszindulatú transzképződését. Az OLP-elváltozásokból kialakuló szájüregi Squammous Cell Carcinoma (OSCCC) preferenciális helyei a nyelv és a bukkális nyálkahártya, és az előfordulási gyakoriság magasabb az előbbinél, míg az epithelialis dysplasia az OLP-ben gyakoribb a bukkális nyálkahártyában.,9
a tüneti orális lichen planus kezelési célja a fájdalmas fekélyek vagy hólyagok gyógyítása. Lépésenkénti megközelítést kell alkalmazni. A helyi kortikoszteroid terápia a fekélyes betegség kezelésének alapja. A randomizált, kontrollált vizsgálatokból csak kevés bizonyíték áll rendelkezésre a különböző, közös használatú készítmények pontos hatékonyságára vonatkozóan., Kiegészítéseként javasolt terápia, a betegeknek is fel kell világosítani, hogy fenn kell tartani egy magas színvonalú szájhigiénia, valamint bármely oka a nyálkahártya-sérülés, például a rosszul illeszkedő protézis, éles csücsök szegény fogászati restaurálások meg kell szüntetni. A betegeket tájékoztatni kell arról, hogy a szájüregi lichen planus-szal kapcsolatban nagyon kicsi a malignitás kockázata, és hogy a hosszú távú monitorozás megfelelő.10
esetünkben a takrolimusz (immunmodulátor) módszeres és szisztematikus alkalmazása drasztikusan javította a tartós elváltozások gyógyulását., A takrolimusz egy makrolid kalcineurin inhibitor. A kalcineurin egy kalcium-és calmodulin-függő szerin / treonin fehérje foszfatáz, amely aktiválja az immunrendszer T-sejtjeit. Amikor a T-sejt receptor aktiválódik, növekszik az intracelluláris kalcium, amely katalizátorként a calmodulin jelenlétében aktiválja a kalcineurint. Ezt a lépést követi a “de foszforiláció”, amely serkenti az aktivált T-sejtek nukleáris faktorának transzkripciós faktorának mozgását a T-sejt magjába, ezáltal növelve az IL-2-t és más citokinokat kódoló gének aktivitását., Ez az egyik mechanizmus, amely OLP-szerű elváltozásokat eredményez. Ebben a betegségmechanizmusban a takrolimusz a defoszforilációs szakaszban (6. ábra) hat, így akadályozza és foszforilációt eredményez. Ez végső soron csökkenti a különböző Il-ket kódoló gének aktivitását, ami megszünteti az OLP-szerű elváltozások felé vezető haladást. Ezt az alábbiakban képi módon ábrázoltuk.11,12
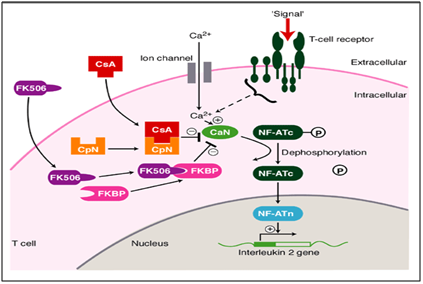
6.ábra a takrolimusz hatásmechanizmusa mint immunmodulátor az orális eróziós zuzmó planus kezelésében.,
különböző vizsgálatok azt találták, hogy a helyi takrolimusz hatékony az OLP kezelésében, és néhányan azt is jelentették, hogy jobb kezdeti terápiás válasz, mint más gyógyszerek, beleértve a kortikoszteroidokat is. De a helyi takrolimusz hatékonyságát értékelő tanulmányok az indiai populációban, különösen hosszú ideig, ritkák. A takrolimusz (0,1% m/v) hatásosnak és biztonságosnak bizonyult az OLP kezelésében különböző kutatók szerint., Megállapították, hogy hatékony eszköz az eróziós vagy fekélyes orális zuzmó planus tüneteinek és jeleinek ellenőrzésére, és 19,8 hónapos átlagos alkalmazási időtartam alatt nem volt jelentős káros hatása.13 egy metaanalízis Chamani G et al.,14 arra a következtetésre jutottak, hogy a helyi takrolimusz a különböző kortikoszteroidok hatékony alternatívája, és az OLEP kezelésében elsővonalbeli kezelésnek tekinthető.