atomer och ljusenergi
studien av atomer och deras egenskaper överlappar flera olikagrupper. Kemister, fysiker och astronomer måste alla förstå denmikroskopiska skalan där mycket av universum fungerar för att se ”större bild”.,
inuti atomen
|
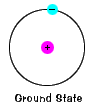
grundtillståndet för en elektron, energinivån detnormalt upptar, är tillståndet för lägsta energi för den elektronen. |
| det finns också en maximal energi som varje elektron kanhar och fortfarande är en del av sin atom. Utöver den energin är elektroneninte längre bunden till atomens kärna och den anses vara joniserad., | 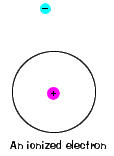
|
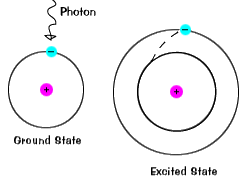 |
när en elektron tillfälligt upptar ett energitillstånd som är större än itsground state, är det i ett upphetsat tillstånd. state.An elektron kan bli upphetsad om den ges extra energi, till exempel om detabsorberar en foton eller ljuspaket eller kolliderar med en närliggande atom eller partikel. |
ljusenergi
illustrationerna på denna sida är naturligtvis förenklade versioner av riktiga atomer. Verkliga atomer, även en relativt enkel som väte, har många olika orbitaler, och så finns det många möjliga energiermed olika initiala och slutliga tillstånd., När en atom är i en excitedtillstånd, elektronen kan släppa hela vägen till marktillståndet på en gång, eller sluta på vägen på en mellanliggande nivå.
|
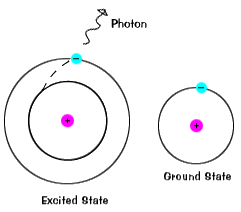
elektroner stannar inte i upphetsade tillstånd under mycket lång tid – de soonreturnerar till sina marktillstånd och avger en foton med sammaenergi som den som absorberades., |
identifiera enskilda typer av atomer
övergångar mellan de olika orbitalerna är unika för varje element eftersom energinivåerna är unikt bestämda av protoner och neutroner i kärnkärnor. Vi vet att olika element har olika antalproton och neutroner i sina kärnor. När elektronerna i en viss atom återvänder till lägre orbitalerfrån upphetsade tillstånd har fotonerna de avger energier som ärkarakteristiska för den typen av atom., Detta ger varjeelement ett unikt fingeravtryck, vilket gör det möjligt att identifiera elementenpresent i en behållare med gas, eller till och med en stjärna.
Vi kan använda verktyg som det periodiska systemet med element för att räkna ut exactlyhow många protoner, och därmed elektroner, en atom har. Först och främst vet viatt för en atom att ha en neutral laddning måste den ha samma antalproton och elektroner. Om en atom förlorar eller får elektroner blir denjoniserad eller laddad. Det periodiska bordet kommer att ge oss atomantalet avett element. Atomnumret berättar hur många protoner en atomhas., Till exempel har väte ett atomnummer av en-vilket innebär att det hasone proton, och därmed en elektron-och har faktiskt inga neutroner.
för studenten
baserat på den tidigare beskrivningen av atomen, rita amodel av väteatomen. ”Standard” – modellen av en atom är kändsom Bohr-modellen.
olika former av samma kemiska element som endast skiljer sig åt med numretof neutroner i deras kärna kallas isotoper. De flesta element Harmer än en naturligt förekommande isotop., Många fler isotoper har producerats i kärnreaktorer och vetenskapliga laboratorier. Isotoper är vanligtvis inte särskilt stabila, och de tenderar att genomgå radioaktivt sönderfall tills något som är stabilare bildas. Du kan vara bekant med elementuran – den har flera instabila isotoper, U-235 är en av de mestvanligt kända. 235 innebär att denna form av uran har 235 neutroneroch protoner kombinerade. Om vi tittade upp uran atomnummer, och substratdet från 235, vi kunde beräkna antalet neutroner som isotop har.,
här är ett annat exempel – kol uppträder vanligtvis i form av C-12 (kol-12), det vill säga 6 protoner och 6 neutroner, även om en isotop är C-13, med 6protons och 7 neutroner.
för studenten
använd det periodiska systemet och namnen på de element som anges nedan för att ta reda på hur många protoner, neutroner och elektroner de har.Rita en modell av en atom av följande element: kisel-28,magnesium-24, svavel-32, syre-16 och helium-4.,
för studenten
med texten definierar du följande termer: energinivåer, absorption, utsläpp, upphetsat tillstånd, markläge, jonisering, atom,element, atommassa, atomnummer, isotop.
en valfri anteckning om atomernas kvantmekaniska Naturmedan Bohr-atomen som beskrivs ovan är ett trevligt sättför att lära sig om atomernas struktur är det inte det mest exakta sättet attmodellera dem., även om varje orbital har en exakt energi, är theelectron nu tänkt som utsmetad i ett ”elektronmoln” som omger kärnan. Det är vanligt att tala om det genomsnittliga avståndet tillhöljet som radien av elektronens orbit.So kom bara ihåg att vi håller orden ”orbit ” och” orbital”, även om vi nu använder dem för att beskriva inte ett platt orbitalplan, men ärgion där en elektron har en sannolikhet att vara. elektroner hålls nära dåukleus av den elektriska attraktionen mellan kärnan och elektronerna.,Hålls där på samma sätt som de nio planeterna stannar nära solen istället förroaming galaxen. Till skillnad från solsystemet, där alla planets banorär på samma plan, elektroner banor är mer tredimensionella. Varjeenerginivå på en atom har en annan form. Det finns matematiskaekvationer som kommer att berätta sannolikheten för elektronens lokaliseringi den omloppsbanan. låt oss övervägaväteatomen, som vi redan ritade en Bohr-modell av.,
texten och bilderna i det här avsnittet anpassades från Dave slavens sida påatomen (se referenser nedan). |

