nukleofil Substitution av hydroxylgruppen
det kemiska beteendet hos alkylhalogenider kan användas som referens för att upptäcka analoga substitutions-och elimineringsreaktioner av alkoholer. Huvudskillnaden är naturligtvis en förändring i den lämnar anjonen från Halid till hydroxid. Eftersom syre är något mer elektronegativ än klor (3.5 vs 2.8 på Pauling-skalan) förväntas C-O-bindningen vara mer polär än en C-Cl-bindning., Dessutom indikerar en oberoende mätning av de elektrofila egenskaperna hos kolatomer från deras NMR-kemiska skift (både 13C och alfa-protoner) att syre-och klorsubstituenter utövar ett liknande elektronutdragande inflytande när de är bundna till sp3 hybridiserade kolatomer. Trots detta lovande bakgrundsbevis genomgår alkoholer inte samma SN2-reaktioner som vanligtvis observeras med alkylhalider. Till exempel har den snabba SN2-reaktionen av 1-bromobutan med natriumcyanid, som visas nedan, ingen parallell när 1-butanol behandlas med natriumcyanid., I själva verket används etylalkohol ofta som lösningsmedel för alkylhalid substitutionsreaktioner som denna.
CH3CH2CH2CH2–Br + Na(+) CN(–)  CH3CH2CH2–CN + Na(+) Br(–)
CH3CH2CH2–CN + Na(+) Br(–)
CH3CH2CH2CH2–OH + Na(+) CN(–)  ingen reaktion
ingen reaktion
nyckelfaktorn här är stabiliteten hos den lämnande anionen (bromid vs hydroxid)., HBr är en mycket starkare syra än vatten (med mer än 18 storleksordningar), och denna skillnad återspeglas i reaktioner som genererar sina respektive konjugatbaser. Den svagare basen, bromid, är stabilare, och dess frisättning i en substitutions-eller elimineringsreaktion är mycket gynnsammare än för hydroxidjon, en starkare och mindre stabil bas.
ett tydligt steg mot att förbättra alkoholernas reaktivitet i SN2 –reaktioner skulle vara att ändra den OH-funktionella gruppen på ett sätt som förbättrar dess stabilitet som en lämnande anjon., En sådan modifiering är att utföra substitutionsreaktionen i en stark syra, omvandling-OH till-OH2 (+). Eftersom hydroniumjon (H3O (+)) är en mycket starkare syra än vatten, är dess konjugatbas (H2O) en bättre lämnande grupp än hydroxidjon. Det enda problemet med denna strategi är att många nukleofiler, inklusive cyanid, avaktiveras genom protonation i starka syror, vilket effektivt avlägsnar det nukleofila samreaktant som krävs för substitutionen., De starka syrorna HCl, HBr och HI är inte föremål för denna svårighet eftersom deras konjugatbaser är goda nukleofiler och är ännu svagare baser än alkoholer. Följande ekvationer illustrerar vissa substitutionsreaktioner av alkoholer som kan påverkas av dessa syror. Som med alkylhalider fortsätter den nukleofila substitutionen av 1º-alkoholer med en SN2-mekanism, medan 3º-alkoholer reagerar med en SN1-mekanism. Reaktioner av 2º-alkoholer kan uppstå av båda mekanismerna och producerar ofta vissa omarrangerade produkter., Siffrorna inom parentes bredvid mineralsyraformlerna representerar viktprocenten av en koncentrerad vattenlösning, den form i vilken dessa syror normalt används.
även om dessa reaktioner ibland kallas ”syrakatalyserad” är detta inte helt korrekt. I den totala omvandlingen omvandlas en stark HX-syra till vatten, en mycket svag syra, så åtminstone en stökiometrisk mängd HX krävs för en fullständig omvandling av alkohol till alkylhalid., Behovet av att använda ekvivalenta mängder av mycket starka syror i denna reaktion begränsar dess användbarhet till enkla alkoholer av den typ som visas ovan. Alkoholer med syrakänsliga grupper tolererar naturligtvis inte sådan behandling. Ändå kan tanken på att ändra den OH funktionella gruppen för att förbättra stabiliteten som en lämnande anjon eftersträvas i andra riktningar. Följande diagram visar några ändringar som har visat sig vara effektiva. I varje fall omvandlas hydroxylgruppen till en ester av en stark syra. De två första exemplen visar de sulfonatestrar som beskrivits tidigare., Det tredje och fjärde exemplet visar bildandet av en fosfitester (X representerar de återstående brominerna eller ytterligare alkoholsubstituenter) respektive en klorosulfitester. Alla dessa lämnar grupper (färgad blå) har konjugatsyror som är mycket starkare än vatten (med 13 till 16 befogenheter tio); således är den lämnar anjon motsvarande stabilare än hydroxidjonen. Mesylat-och tosylatföreningarna är särskilt användbara eftersom de kan användas i substitutionsreaktioner med en mängd olika nukleofiler., Intermediärerna som produceras i reaktioner av alkoholer med fosfortribromid och tionylklorid (sista två exempel) isoleras sällan, och dessa reaktioner fortsätter att producera alkylbromid och kloridprodukter.
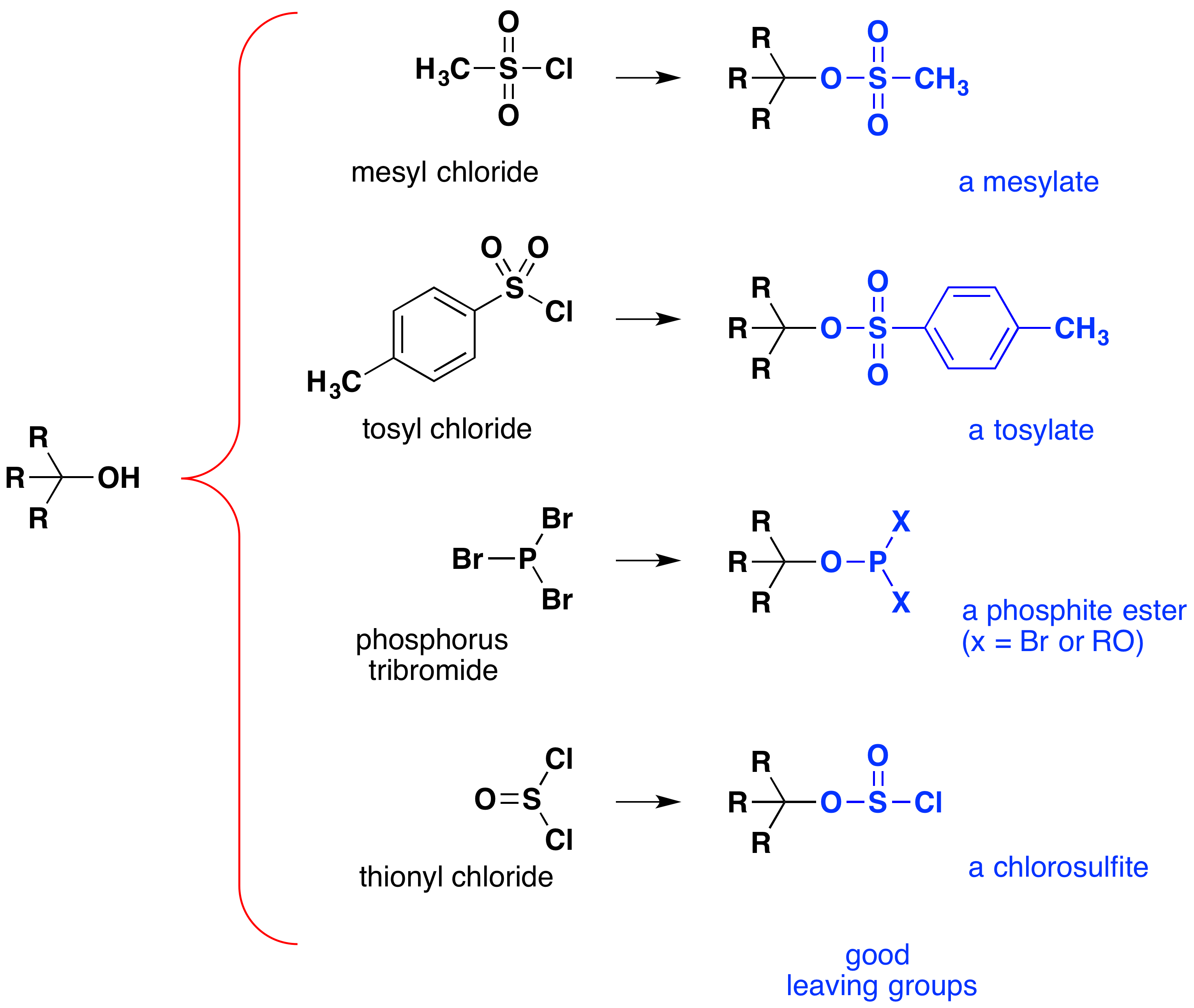
betydelsen av sulfonatester intermediärer i allmänna nukleofila substitutionsreaktioner av alkoholer kan illustreras genom följande omvandling av 1-butanol till pentanenitril (butylcyanid), en reaktion som inte sker enbart med alkoholen., Fosfor-och tionylhaliderna verkar däremot endast för att omvandla alkoholer till motsvarande alkylhalider.,
| CH3CH2CH2CH2–OH + CH3SO2Cl | pyridine
|
CH3CH2CH2CH2–OSO2CH3 | Na(+) CN(–)
|
CH3CH2CH2CH2–CN + CH3SO2O(–) Na(+) |
Some examples of alcohol substitution reactions using this approach to activating the hydroxyl group are shown in the following diagram., De två första fallen tjänar till att förstärka det faktum att sulfonatesterderivat av alkoholer kan ersätta alkylhalider i en mängd olika SN2-reaktioner. De följande två fallen visar användningen av fosfortribromid vid omvandling av alkoholer till bromider. Detta reagens kan användas utan tillsats av bas (t. ex. pyridin) eftersom fosforsyreprodukten är en svagare syra än HBr. Fosfortribromid används bäst med 1º-alkoholer eftersom 2º-alkoholer ofta ger omarrangemang biprodukter som härrör från konkurrerande SN1-reaktioner., Observera att etersyret i reaktion 4 inte påverkas av detta reagens, medan den alternativa syntesen med koncentrerad HBr klyver etrar. Fosfortriklorid (PCl3) omvandlar alkoholer till alkylklorider på liknande sätt, men tionylklorid är vanligtvis att föredra för denna omvandling eftersom de oorganiska produkterna är gaser (SO2 & HCl). Fosfortrijodid är inte stabil men kan genereras på plats från en blandning av röd fosfor och jod och verkar för att omvandla alkoholer till alkyljodider., Det sista exemplet visar reaktionen av tionylklorid med en chiral 2º-alkohol. Närvaron av en organisk bas som pyridin är viktig eftersom den ger en väsentlig koncentration av kloridjon som krävs för den slutliga SN2-reaktionen av klorosufitmediären., I avsaknad av en bas sönderdelas klorosufiter vid uppvärmning för att ge den förväntade alkylkloriden med kvarhållande av konfigurationen
tertiära alkoholer används inte vanligtvis för substitutionsreaktioner av den typ som diskuteras här eftersom SN1 och E1-reaktionsvägarna är dominerande och är svåra att kontrollera.

betydelsen av sulfonatestrar som intermediärer i många substitutionsreaktioner kan inte överskattas., Ett rigoröst bevis på konfigurationsinversion som uppstår vid substitutionsstället i SN2-reaktioner använder sig av sådana reaktioner. Ett exempel på ett sådant bevis visas nedan. Förkortningar för de vanligaste sulfonylderivaten ges i följande tabell.
| Sulfonylgrupp | CH3SO2– | CH3C6H4SO2– | brc6h4so2– | cf3so2– |
|---|---|---|---|---|
| namn & abbrev., | Mesyl eller Ms | Tosyl eller Ts | Brosyl eller Bs | Trifyl eller TF |
Inversionssäker

för en mer fullständig diskussion om hydroxylsubstitutionsreaktioner och en beskrivning av andra selektiva metoder för denna omvandling, klicka här.
Bidragsgivare
- William Reusch, Professor Emeritus (Michigan State U.,), Virtual Textbook of Organic Chemistry