en kort sammanfattning av Haberprocessen
Haberprocessen kombinerar kväve från luften med väte som huvudsakligen härrör från naturgas (metan) till ammoniak. Reaktionen är reversibel och produktionen av ammoniak är exoterm.,
![]()
![]()
ett flödesschema för Haberprocessen ser ut så här:
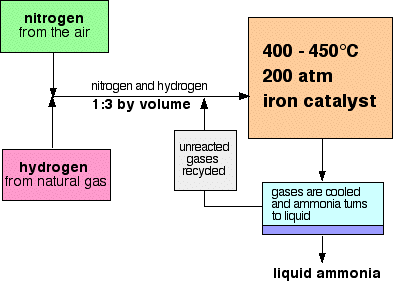
vissa anmärkningar om villkoren
katalysatorn
katalysatorn är faktiskt lite mer komplicerad än rent järn. Den har kaliumhydroxid tillsatt som en promotor-ett ämne som ökar effektiviteten.
trycket
trycket varierar från en tillverkningsanläggning till en annan, men är alltid högt. Du kan inte gå långt fel i en tentamen som citerar 200 atmosfärer.,
återvinning
Vid varje passage av gaserna genom reaktorn omvandlas endast cirka 15% av kväve och väte till ammoniak. (Denna siffra varierar också från växt till växt.) Genom kontinuerlig återvinning av oreagerat kväve och väte är den totala omvandlingen cirka 98%.
förklara villkoren
proportionerna av kväve och väte
blandningen av kväve och väte som går in i reaktorn är i förhållandet 1 volym kväve till 3 volymer väte.,
Avogadros lag säger att lika stora volymer gaser vid samma temperatur och tryck innehåller lika många molekyler. Det betyder att gaserna går in i reaktorn i förhållandet 1 kvävemolekyl till 3 väte.
det är den andel som ekvationen kräver.
i vissa reaktioner kan du välja att använda ett överskott av ett av reaktanterna. Du skulle göra detta om det är särskilt viktigt att använda upp så mycket som möjligt av den andra reaktanten – om det till exempel var mycket dyrare. Det gäller inte i det här fallet.,
det finns alltid en nedsida för att använda något annat än ekvationsproportionerna. Om du har ett överskott av en reaktant kommer det att finnas molekyler som passerar genom reaktorn som inte kan reagera eftersom det inte finns något för dem att reagera med. Detta avfall reaktorutrymme-särskilt utrymme på ytan av katalysatorn.
temperaturen
Jämviktshänsyn
Du måste flytta jämviktsläget så långt som möjligt till höger för att producera den maximala möjliga mängden ammoniak i jämviktsblandningen.,
framreaktionen (ammoniakproduktionen) är exoterm.
![]()
![]()
enligt Le Chateliers princip kommer detta att gynnas om du sänker temperaturen. Systemet kommer att reagera genom att flytta jämviktsläget för att motverka detta – med andra ord genom att producera mer värme.
för att få så mycket ammoniak som möjligt i jämviktsblandningen behöver du så låg temperatur som möjligt. 400 – 450°C är dock inte en låg temperatur!,
Hastighetsöverväganden
ju lägre temperatur du använder desto LÅNGSAMMARE blir reaktionen. En tillverkare försöker producera så mycket ammoniak som möjligt per dag. Det är ingen mening att försöka uppnå en jämviktsblandning som innehåller en mycket hög andel ammoniak om det tar flera år för reaktionen att nå den jämvikten.
du behöver gaserna för att nå jämvikt inom den mycket korta tid som de kommer att vara i kontakt med katalysatorn i reaktorn.,
kompromissen
400 – 450°C är en kompromisstemperatur som ger en relativt hög andel ammoniak i jämviktsblandningen (även om den bara är 15%), men på mycket kort tid.
trycket
Jämviktshänsyn
![]()
![]()
Observera att det finns 4 molekyler på vänster sida av ekvationen, men bara 2 till höger.,
enligt Le Chateliers princip, om du ökar trycket reagerar systemet genom att gynna reaktionen som producerar färre molekyler. Det kommer att få trycket att falla igen.
för att få så mycket ammoniak som möjligt i jämviktsblandningen behöver du så högt tryck som möjligt. 200 atmosfärer är ett högt tryck, men inte otroligt högt.
Hastighetsöverväganden
att öka trycket för molekylerna närmare varandra., I det här fallet kommer det att öka sina chanser att slå och hålla fast vid katalysatorns yta där de kan reagera. Ju högre trycket desto bättre när det gäller graden av en gasreaktion.
ekonomiska överväganden
mycket höga tryck är mycket dyra att producera på två punkter.
Du måste bygga extremt starka rör och inneslutningskärl för att klara det mycket höga trycket. Det ökar dina kapitalkostnader när anläggningen är byggd.
höga tryck kostar mycket att producera och underhålla., Det betyder att driftskostnaderna för din anläggning är mycket höga.
kompromissen
200 atmosfärer är ett kompromisstryck som valts av ekonomiska skäl. Om trycket som används är för högt överstiger kostnaden för att generera det priset du kan få för den extra ammoniak som produceras.
katalysatorn
Jämviktsaspekter
katalysatorn har ingen som helst effekt på jämviktens position. Att tillsätta en katalysator ger inte någon större andel ammoniak i jämviktsblandningen. Dess enda funktion är att påskynda reaktionen.,
ränta överväganden
i avsaknad av en katalysator reaktionen är så långsam att praktiskt taget ingen reaktion händer i någon förnuftig tid. Katalysatorn säkerställer att reaktionen är tillräckligt snabb för att en dynamisk jämvikt ska kunna upprättas inom den mycket korta tid som gaserna faktiskt finns i reaktorn.
separera ammoniak
när gaserna lämnar reaktorn är de heta och vid ett mycket högt tryck., Ammoniak kan lätt kondenseras under tryck så länge det inte är för varmt, och så sänks temperaturen i blandningen tillräckligt för att ammoniaken ska vända sig till en vätska. Kväve och väte förblir som gaser även under dessa höga tryck, och kan återvinnas.
frågor för att testa din förståelse
om detta är den första uppsättningen frågor du har gjort, läs introduktionssidan innan du börjar. Du måste använda bakåtknappen på din webbläsare för att komma tillbaka hit efteråt.,
frågor om Haberprocessen
svar
var Vill du gå nu?
till jämviktsmenyn . . .
till menyn fysikalisk kemi . . .
till huvudmenyn . . .