introduktion
under vintern får dermatologer ibland asymptomatiska patienter, utan några specifika skador än kanske någon post-inflammatorisk missfärgning, men med ett desperat behov av hjälp. De börjar berätta historien om ett antal papler eller blåsor som uppträder på huden efter årets första intensiva solexponering., Tillsammans med skadorna börjar en fruktansvärd klåda och ökar med spridningen av sjukdomen, efter nästa sol exponering, ibland förvärrad av en slags brännande känsla. Ändå är detta folk modell Sun seekers och fortsätter att njuta av solskenet under hela sommaren och väntar på att papulorna gradvis bleknar och försvinner. De viktigaste frågorna är: hur kan jag förhindra detta? Varför får jag det här problemet sedan ” 5 ” år nu, men jag hade det aldrig tidigare?,
Vi har troligen att göra med polymorf ljusutbrott (PLE) och efter våra patienters önskemål har medicinsk forskning huvudsakligen varit inriktad på förebyggande strategier blivit idag ganska tillfredsställande. Å andra sidan är den andra och säkerligen mindre utforskade frågan oklart, om inte flera bitar har lagts till i detta ganska komplicerade pussel. Syftet med denna korta översyn är att återuppta de senaste framstegen inom PLE möjliga mekanismer och de mest använda protokollen för förebyggande eller behandling.
Patofisiologi av polymorf Ljusutbrott: Vad är nytt?,
PLE är den vanligaste ljuskänsliga sjukdomen, kännetecknad av ett intermittent utbrott av icke-ärrbildning pruritiska erytematösa papiller, blåsor eller plack (Figur 1) som utvecklas inom timmar efter ultraviolett strålning (UVR) exponering av patienthud. Sjukdomen är beroende av genetisk mottaglighet, såväl som miljökomponent, såsom typ av exponering. PLE verkar kluster i familjer: det har uppskattats att förekomsten av PLE var 21 och 18% i monozygotiska och dizygotiska tvillingar, respektive (1)., Dessutom var en positiv familjehistoria av PLE i första gradens släktingar närvarande i 12% av drabbade tvillingpar med avseende på 4% av opåverkade tvillingpar (p < 0.0001). Probandvis konkordansen i monozygotiska var överlägsen än i dizygotiska tvillingpar (0, 72 respektive 0, 30), vilket visade en stark genetisk effekt (1). Många gener av potentiellt intresse för patogenesen av PLE har undersökts med i allmänhet unrewarding resultat., Med hjälp av segregationsanalys har man uppskattat att 72% av den brittiska befolkningen har en låg penetrance PLE-mottaglighetsallel (2).
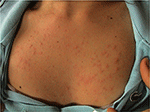
Figur 1. Klinisk bild av polymorf ljusutbrott i en ung kvinna.
misslyckandet av apoptos: de möjliga Fotoinducerade Neo-antigener
i en nyligen genom-omfattande expressionsanalys uttrycktes endast 16 gener differentiellt mellan PLE och friska kontroller efter UV-bestrålning avseende kontroll (3)., Av dessa gener visade 14 lägre uttryck hos PLE-patienter, medan två resulterade i över uttryck. Bland de 14 gener med lägre uttryck i PLE är: komplettera 1s subenheten (C1s), scavenger receptor B1 (SCARB1) fibronektin (FN1), immunglobulin superfamilj medlem 3 (IGSF3), caspaser-1 (CASP1) och paraoxonase 2 (PON2), alla gener associerade med apoptotiska cell av krigsmateriel. Det har antagits att proteinmodifiering under apoptotisk cellclearance kan leda till potentiell auto-antigenbildning (4)., Därefter kan det reducerade uttrycket hos PLE-patienter av gener som är kopplade till denna process representera en möjlig Auto-antigenkälla, liksom en avgörande fas i inledningen av den autoimmuna processen som främjar sjukdomen (3). I enlighet med dessa resultat, Kuhn et al. visade ackumulering av apoptotiska celler i PLE-patienter bestrålade antingen med 1.5 Minimal Erytemdos (med) av UVB, eller 60-100 J/cm2 av UVA1, jämfört med kontroller (5).,
immunitet: Toleransfel
autoantigener som härrör från ineffektiv clearance av apoptotiska celler, tas förmodligen upp av dendritiska celler (DCs) och presenteras för naiva T-celler (cytotoxiska och hjälpare) därefter omvandlas i auto-reaktiva T-celler (6, 7). Detta partiella misslyckande av apoptosen bidrar, tillsammans med den otillräckliga immunosuppressionen efter UV-exponering, till antigenigenkänningen och presentationen, vilket leder till den kliniska manifestationen som är typisk för PLE-patienter (8)., Faktum är att misslyckandet av normal UVR-inducerad immunosuppression har bevisats som den huvudsakliga immunologiska abnormiteten i PLE, förklarade initialt av Langerhans cells beständighet (LCs) i epidermis. Denna överaktivering av immunsystemet, som flyr till den funktionella UV-inducerade toleransen, är förmodligen ansvarig för den minskade hudcancerprevalensen hos PLE-patienter (9). Å andra sidan är samma mekanism skyldig för misslyckande av allergisk kontaktdermatit (ACD) undertryckande, efter UVR-exponering (10).,
inflammatorisk väg: fördröjd överkänslighetsreaktion
de immunologiska mekanismer som är involverade i PLE, med mediatorer från det medfödda och adaptiva immunsystemet, är mycket lika, antingen från histologisk eller biokemisk synvinkel, till ACD. I början av sjuttiotalet indikerade Epstein först PLE som en fördröjd överkänslighetsreaktion (dthr) mot odefinierat UVR-inducerat kutan antigen (11). Nyligen, för att förstärka detta koncept, har några av de inflammatoriska mediatorerna som är involverade i ACD demonstrerats också i PLE., Till exempel har IL-1-familjen (12, 13), en växande grupp cytokiner som spelar flera roller i immunreglering och inflammation (14), som också är involverade i ACD-patogenes (12, 15), undersökts också i PLE (16). IL-36α och IL-36γ ökade de proinflammatoriska medlemmarna i IL-1-familjen i PLE avseende kontroller, som för ACD-prover, men IL-36γ förstärktes mycket i PLE än i ACD (16). Genom den gemensamma receptor består av IL-36R och IL-1R/Avs – (IL-1RL2), IL-36α, IL-36β, och IL-36γ aktivera NF-kB och MAPKs, främjande av inflammatoriska reaktioner., Ökningen av IL-36s i hud och perifert blod hos PLE-patienter indikerar aktiveringen av lokalt och systemiskt immunsvar, vilket finns i flera inflammatoriska hudförhållanden (15, 17, 18). Förmodligen är länken mellan Il-36s och UVR-exponering representerad av parakrinproinflammatorisk signal av toll – liknande receptor (TLR)-3-aktivering, på grund av frisättningen av RNA genom nekrotiska keratinocyter (19). Faktum är att misslyckandet av apoptotisk clearance i PLE, med överflöd av cellulära skräp, kan vara ansvarig för en förstärkning av denna ”varningssignal.,”
dessutom kan IL-36s bidra till att förstärka den medfödda immunsignalen och den därav följande inflammatoriska kaskaden, främja antimikrobiella peptider (AMPs) (20).
Inflammatoriska Väg: – AMPs och Mikrobiomet
Som till stor del undersökts i flera huden inflammatoriska processer, dessa medlare, som heter defensins (α och β), cathelicidin (LL37), ribonuclease 7 (RNase7) och psoriasin (S100A7), i ljuset av den obalans som orsakas av uv-strålning på keratinocyter och huden mikrobiomet, har också undersökts i PLE (21, 22). Patra et al., har funnit att uttrycket av psoriasin, RNase7, HBD-2, och LL-37 har ökat i PLE lesionell huden, medan HBD-3 minskat. Med tanke på hudytan som en ”multietnisk värld”, utan att glömma keratinocyternas avgörande roll, kan vi inte utesluta att AMPs-frisättning kan bestämmas genom modifiering i mikrobiomekomponenter efter UV-interaktion (23). Faktum är att mikrobiom kan representera källan, direkt eller indirekt, av de ännu oupptäckta UVR-inducerade antigenerna som bildas hos PLE-patienter, vilket leder till keratinocytskador., Som en konsekvens kan LL-37, som också induceras av UVB, IFNy, TNF-α, IL-6, utgöra en potentiell indirekt drivkraft för PLE (23). Det kan bilda aggregat med självkärnsyror som kan aktivera PDC: i psoriasis har det erkänts som den huvudsakliga autoantigen (24). Även om i PLE-patienter en fullständig frånvaro av PDC har rapporterats (25), finns en autoimmun miljö, och LL-37 kan spela en pivotal Roll, inducera andra inflammatoriska vägar. I Figur S1 (kompletterande Material) visualiseras begreppen ovan i en tecknad film.
terapi av polymorf Ljusutbrott: Vad är nytt?,
den första behandlingslinjen för PLE inkluderar solskydd, solskyddsmedel och topiska kortikosteroider (26). För alla patienter är förebyggande hantering grundläggande Under soligt väder, genom att undvika intensiv UVR-exponering och användning av skyddskläder, samt applicering av solskyddsmedel, särskilt under årets första exponering. Ny generation brett spektrum solskyddsmedel med hög solskyddsfaktor för UVB (SPF), tillsammans med längre våglängd UVA-skydd, har rapporterats ge totalt eller partiellt skydd i upp till 90% av PLE patienter (27, 28)., Användningen av orala antioxidanter och nikotinamid kan utgöra en ytterligare giltig förebyggande åtgärd för dessa patienter. De positiva effekterna av nikotinamid har undersökts i en okontrollerad studie på 42 patienter, där 60% av dem rapporterade fullständigt avskaffande av symtom när de tog 2-3 g nikotinamid dagligen före solexponering (29). Dessutom har ett extrakt av den tropiska ormbunken Polypodiumleucotomos [PL) visat sig utöva både potenta antioxidant och immunmodulerande effekter., Vid administrering vid 480 mg / dagligen före solexponering det signifikant minskade hudreaktioner och subjektiva symptom (30, 31). När det gäller topisk kortikosteroid, även om inga studier har gjorts för att bestämma deras effekt i PLE, används de ofta för att minska klåda (26). Den andra raden av behandlingar för PLE inkluderar systemiska kortikosteroider och foto(kemo)terapi (26). I en randomiserad, dubbelblind, placebokontrollerad studie (32) föreslog författarna användningen av 25 mg prednisolon dagligen i 4-5 dagar vid utbrottets början., Även om de potentiella långsiktiga biverkningarna av upprepade kurser av prednisolon måste övervägas, kan det rekommenderas för patienter som lider av tillfälliga attacker av PLE, i avsaknad av kontraindikationer. I mildare fall av PLE kan ett självkonditioneringsprogram genom graduate exponering för solljus under våren vara tillräckligt (33). Medan, i mer allvarliga fall, medicinskt övervakad konditionering/desensibilisering behandling kan vara mer lämpligt., En kurs av psoralen och UVA terapi (PUVA), smalband (NB)-UVB eller bredband (BB)-UVB ljusterapi, vanligtvis administreras tidigt på våren, kan vara effektiv samt profylaktisk behandling (26). Behandlingsprotokoll består i allmänhet av en kurs av fototerapi / fotokemoterapi över 5-6 veckor. Startdoser beror på minimal erythemal dos (med) eller minsta fototoxiska dos (MPD), och är ofta 50-70% av dessa uppmätta tröskelvärden med inkrementella ökningar., För att bibehålla den fördel som förvärvats med desensibiliserande terapi, rekommenderas en regelbunden sol exponering under hela sommaren, annars kan härdningen gå förlorad inom 4-6 veckor. Vid behandling av PLE bör NB-UVB föredras för PUVA (styrka av rekommendation D; bevisnivå 4), på grund av den lägre risken för fotokarcinogenes, ingen risk för illamående eller andra biverkningar i samband med intag av MOP och inget behov av att använda ögonskydd efter behandling. PUVA bör dock övervägas, före andra systemiska behandlingar, om NB-UVB har misslyckats eller tidigare har utlöst utbrottet., I själva verket, såsom beskrivs nedan, har effekten visats för flera ljusterapi regimer (BB-UVB, NB-UVB och PUVA), och biverkningar, i termer av utslag provokation, erytem och klåda befanns vara vanligare med UVB än med PUVA (34). Sammanfattningsvis, i litteraturen, resulterar effekten av PUVA i en 65-100% fotoprotektionsfrekvens (34)., Flera jämförande studier har utförts, men från den enda randomiserade kontrollerade studien mellan PUVA och NB-UVB plus placebo tabletter, tre gånger i veckan, i 5 veckor, uppstod ingen signifikant skillnad i effekt, med tanke på förekomst av PLE eller utomhusaktivitetsbegränsning (35). I 10 år retrospektiv översyn, rapporterats av Man et al. (36), 170 patienter med måttlig till svår PLE fick PUVA och/eller UVB ljusterapi. I detalj fick 8 patienter PUVA, 128 NB-UVB, 5 BB-UVB och 29 patienter, som inte svarade tillfredsställande på NB-UVB, PUVA följande år., Självbedömningar gjordes av svårighetsgraden, och frekvensen av PLE-episoder rapporterades vid uppföljningsbesöken på hösten eller under följande vår. God eller måttlig förbättring rapporterades hos 88% av patienterna som behandlades med PUVA och hos 89% som fick UVB. Av de patienter som behandlades med både PUVA och NB-UVB föredrog majoriteten PUVA. I en annan 14-årig retrospektiv studie på 79 patienter som behandlades med fototerapi (37), var effekten, mätt under följande sommar i termer av fotoprotektion med fullständig/partiell remission, 65% för PUVA, 82% för BB-UVB och 83% för UVA enbart., I detta fall var behandlingen med PUVA reserverad för mer allvarliga PLE-former.
de mekanismer genom vilka fototerapi inducerar fotoprotektion är inte fullständigt förstådda.
under de senaste åren har dock många framsteg gjorts. Förutom de välkända effekterna på melaninisering och epidermal förtjockning av fototerapi rapporteras ett brett spektrum av UV-inducerade immunmodulerande och antiinflammatoriska egenskaper (38)., Både UVB och UVA modulerar vidhäftningsmolekyluttryck och inducerar lösliga mediatorer, såsom A-melanocytstimulerande hormon, IL-10 (som undertrycker produktionen av interferon γ) och prostaglandin E2, som förklarar antiinflammatoriska åtgärder, förhindrar T-celler aktivering och främjar apoptos av hudinfiltrerande T-celler (34). Dessutom har det visats att profylaktisk UV-fotohardering hos PLE-patienter återställer den UV-inducerade LC-migreringen från epidermis till huddränerande lymfkörtlar: en av de viktigaste cellulära händelserna i UV-immunosuppression (39)., Toleransen inducerad av LC medieras genom frisättning av immunosuppressiv cytokin såsom IL-10, och genom interferens med mognad och induktion av regulatoriska T-celler (Tregs) (40). Dessutom har nyligen en intressant länk rapporterats bland LC, Tregs och vitamin D3. Det har faktiskt visat sig att en kortvarig 1-veckas topisk förbehandling med 1,25-dihydroxyvitamin d-analogen, kalcipotriol, minskade PLE-symtom efter efterföljande experimentell fotoprovokation (41)., Dessutom visade i en Murin studie 1,25-dihydroxyvitamin d jämförbara immunosuppressiva effekter som UV (42). En annan intressant crosstalk har markerats mellan LCs och mastceller. Förutom deras erkända roll i atopi är dermal mastceller också ansvariga för att skydda huden från UVB-inducerad inflammation, vilket främjar UV-immunosuppression (40). Mänskliga studier har visat att efter akut och kronisk UVR-exponering ökar antalet dermala mastceller, tillsammans med frisättningen av IL-10., Sammantaget tyder dessa data på en potentiell roll för mastceller i PLE och i mekanismen för fotohardering. I enlighet med detta, Wolf et al. har rapporterat, för första gången, att photohardening ökar signifikant mastcelldensitet i papillär dermis hos PLE-patienter (40). Sammanfattningsvis arbetar photohardening i PLE genom att återställa den normala UV-immunsuppressiva vägen, som involverar flera celltyper. Den tredje linjens behandling för PLE innefattar användning av systemiska immunosuppressiva läkemedel, såsom azatioprin och cyklosporin., Endast sporadiska fall av patienter som framgångsrikt behandlats rapporteras dock i litteraturen (43, 44). Dessutom har hydroxiklorokin, omega-3-fettsyror och beta-karoten föreslagits som behandlingar, men ytterligare dubbelblinda, randomiserade kontrollerade studier för att verkligen bedöma deras kliniska effekt krävs.
slutsatser
eftersom den höga prevalensen och den ökande förekomsten av PLE, i samband med obehag och begränsningar i livsstil, är framtida studier nödvändiga för att hitta nya terapeutiska och / eller förebyggande strategier., Valet av lämplig PLE-behandling kräver god kunskap om sjukdoms individuella kliniska förlopp tillsammans med möjligheten att utföra fototest. Några nya aspekter i eventuell aktivering och främjande av inflammatorisk process har lyfts fram.,
till det nuvarande kunskapsläget, trots identifieringen av någon avgörande cellulär reglering som är involverad i återställandet av immuntoleransen, är det svårt att dra bestämda slutsatser om effekten av olika potentiella behandlingar i PLE, på grund av brist på adekvata studier och svårigheten att bedöma utfallsåtgärder. Den kliniska poängen för att bedöma PLE-svårighetsgrad (PLESI) (45) är fortfarande ett instrument som knappast används och huvudsakligen begränsat till forskningsändamål., Den djupare studien av de underliggande patogenetiska mekanismerna för sjukdomen kommer att möjliggöra en mer målinriktad behandling.
Författarbidrag
SL projicerade manuskriptet, valde materialet för papperet, skrev det ursprungliga utkastet och korrigerade följande utkast till manuskriptet. AR var engagerad i manuskriptets skrivning och stödde nya idéer om innehåll och stil.,
intressekonflikt uttalande
författarna förklarar att forskningen genomfördes i avsaknad av kommersiella eller finansiella relationer som kan tolkas som en potentiell intressekonflikt.
kompletterande Material
figur S1. Samspel mellan medfödd och adaptivt immunsystem i ett sammanhang av apoptosfel i epidermis. (Grön symbol) Psoriasin: rikligt uttryck i spinösa och granulära skikt av PLE hud. (Blå symbol) RNase7: huvudsakligen uttrycks i keratinocyter i stratum granulosum och stratum corneum av PLE lesioner., (Gul symbol) LL-37 uttrycktes djupt i och runt blodkärl och körtlar i PLE. (Violett cellsymbol) apoptotiska keratinocyter med ineffektiv clearance.,hic light eruption; ACD, Allergic contact dermatitis; DTHR, Delayed type hypersensitivity reaction; UVR, Ultraviolet radiation; C1s, Complement 1s subunit; SCARB1, Scavenger receptor B1; FN1, Fibronectin; IGSF3, Immunoglobulin superfamily member 3; CASP1, Caspase-1; PON2, Paraoxonase 2; MED, Minimal Erythema Dose; DCs, Dendritic cells; LCs, Langerhans cells; TLR, Toll like receptor; AMPs, Antimicrobial peptides; SPF, Sun protection factor; PUVA, Psoralen and UVA therapy; NB-UVB, Narrowband; BB-UVB, Broadband UVB; MPD, Minimum phototoxic dose; Tregs, Regulatory T cells; PL, Polypodiumleucotomos.,
2. McGregor JM, Grabczynska S, Vaughan R, Hawk JL, Lewis CM. Genetic modelling of abnormal photosensitivity in families with polymorphic light eruption and actinic prurigo. J Invest Dermatol. (2000) 115:471–6. doi: 10.1046/j.1523-1747.2000.00080.x
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Lembo S, Hawk JLM, Murphy GM, Kaneko K, Young AR, McGregor JM, et al., Aberrant gene expression with deficient apoptotic keratinocyte clearance may predispose to polymorphic light eruption. Br J Dermatol. (2017) 177:1450–3. doi: 10.1111/bjd.15200
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Savill J, Fadok V. Corpse clearance defines the meaning of cell death. Nature (2000) 407:784–8. doi: 10.,1038/35037722
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Kuhn A, Herrmann M, Kleber S, Beckmann-Welle M, Fehsel K, Martin-Villalba A, et al. Accumulation of apoptotic cells in the epidermis of patients with cutaneous lupus erythematosus after ultraviolet irradiation. Arthritis Rheum. (2006) 54:939–50. doi: 10.1002/art.21658
PubMed Abstract | CrossRef Full Text | Google Scholar
6., Savill J, Dransfield I, Gregory C, Haslett C. A blast from the past: clearance of apoptotic cells regulates immune responses. Nat RevImmunol. (2002) 2:965–75. doi: 10.1038/nri957
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Albert ML, Sauter B, Bhardwaj N. Dendritic cells acquire antigen from apoptotic cells and induce class I-restricted CTLs. Nature (1998) 392:86–9. doi: 10.,1038/32183
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Koulu LM, Laihia JK, Peltoniemi HH, Jansén CT. UV-induced tolerance to a contact allergen is impaired in polymorphic light eruption. J Invest Dermatol. (2010) 130:2578–82. doi: 10.1038/jid.2010.181
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Epstein JH. Polymorphous light eruption. J Am Acad Dermatol. (1980) 3:329–43.,
PubMed Abstract | Google Scholar
12. Mattii M, Ayala F, Balato N, Filotico R, Lembo S, Schiattarella M, et al. The balance between pro- and anti-inflammatory cytokines is crucial in human allergic contact dermatitis pathogenesis: the role of IL-1 family members. Exp Dermatol. (2013) 22:813–9. doi: 10.1111/exd.12272
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Dinarello CA., Interleukin-1 i patogenesen och behandlingen av inflammatoriska sjukdomar. Blod (2011) 117:3720-32. doi: 10.1182 / blod-2010-07-273417
PubMed Abstract | CrossRef Full Text/Google Scholar
16. Lembo S, Caiazzo G, Balato N, Monfrecola G, Patra V, Varg P, et al. Polymorf ljusutbrott och IL-1 familjemedlemmar: någon skillnad med allergisk kontaktdermatit? Photochem Photobiol Sci. (2017) 16:1471–9. doi: 10.,1039/c7pp00142h
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Balato A, Schiattarella M, Lembo S, Mattii M, Prevete N, Balato N, et al. Interleukin-1 family members are enhanced in psoriasis and suppressed by vitamin D and retinoic acid. Arch Dermatol Res. (2013) 305:255–62. doi: 10.1007/s00403-013-1327-8
PubMed Abstract | CrossRef Full Text | Google Scholar
19., Borkowski AW, Kuo IH, Bernard JJ, Yoshida T, HERR Williams, Hängde NJ. Toll-liknande receptor 3 Aktivering krävs för normal hudbarriär reparation efter UV-skada. J. Investera Dermatol. (2015) 135:569–78. doi: 10.1038/jid.2014.354
PubMed Abstract / CrossRef Full Text / Google Scholar
20. Li N, Yamasaki K, Saito R, Fukushi-Takahashi S, Shimada-Omori R, Asano M, et al. Alarmin funktion av cathelicidin antimikrobiell peptid LL37 genom IL-36γ induktion i human epidermal keratinocyter. J Immunol., (2014) 193:5140–8. doi: 10.4049/jimmunol.1302574
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Patra V, Wolf P. Microbial elements as the initial triggers in the pathogenesis of polymorphic light eruption? Exp Dermatol. (2016) 25:999–1001. doi: 10.1111/exd.13162
PubMed Abstract | CrossRef Full Text | Google Scholar
22., Gläser R, Navid F, Schuller W, Jantschitsch C, Hårdare J, Schröder JM, et al. UV-B-strålning inducerar uttrycket av antimikrobiella peptider i humana keratinocyter in vitro och in vivo. J Allergy Clin Immunol. (2009) 123:1117–23. doi: 10.1016 / j. jaci.2009.01.043
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Patra V Mayer G, Gruber-Wackernagel En, Horn M, Lembo S, Varg P., Unik profil av antimikrobiell peptid uttryck i polymorfa ljusutbrott lesioner jämfört med frisk hud, atopisk dermatit och psoriasis. Photodermatol Photoimmunol Photomed. (2018) 34:137–44. doi: 10.1111/phpp.12355
PubMed Abstract / CrossRef Full Text / Google Scholar
25. Schweintzger NA, Gruber-Wackernagel En, Shirsath N, Quehenberger F, Obermayer-Pietsch B, Varg P. Inflytande av årstiderna på D-vitamin nivåer och regulatoriska T-celler i patienter med polymorfa ljus utbrott., Photochem Photobiol Sci. (2016) 15:440–6. doi: 10.1039/c5pp00398a
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Proby C, Baker C, Morton O, Hawk JLM. New broad spectrum sunscreen for polymorphic light eruption. Lancet (1993) 341:1347–8.
PubMed Abstract | Google Scholar
28. Allas S, Lui H, Moyal D, Bissonnette R., Jämförelse av förmågan hos 2 solskyddsmedel för att skydda mot polymorf ljusutbrott inducerad av en UV-A / UV-B metallhalogenlampa. Arch Dermatol. (1999) 135:1421–2.
PubMed Abstract / Google Scholar
29. Ortel B, Wechdorn D, Tanew En, Honigsmann H. Effekten av nikotinamid på phototest reaktion i polymorphous lighteruption. Br J Dermatol. (1988) 118:669–73.
PubMed Abstract / Google Scholar
30., Caccialanza M, Percivalle S, Piccinno R, Brambilla R. Photoprotective activity of oral Polypodiumleucotomos extract in 25 patients with idiopathic photodermatoses. Photodermatol Photoimmunol Photomed. (2007) 23:46–7. doi: 10.1111/j.1600-0781.2007.00274.x
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Tanew A, Radakovic S, Gonzalez S, Venturini M, Calzavara-Pinton P. Oral administration of a hydrophilic extract of Polypodiumleucotomos for the prevention of polymorphic light eruption., J Am Acad Dermatol. (2012) 66:58–62. doi: 10.1016/j.jaad.2010.09.773
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Van Praag MCG Boom, BW, Vermeer BJ. Diagnosis and treatment of polymorphous light eruption. Int J Dermatol. (1994) 33:233–9.
Google Scholar
34. Ling TC, Clayton TH, Crawley J, Exton LS, Goulden V, Ibbotson S, et al., British association av dermatologer och british photodermatology group riktlinjer för säker och effektiv användning av psoralen-ultraviolett En behandling 2015. Br J Dermatol. (2016) 174:24–55. doi: 10.1111/bjd.14317
PubMed Abstract / CrossRef Full Text / Google Scholar
36. Man I, Dawe RS, Ferguson J. artificiell härdning för polymorf ljusutbrott: praktiska punkter från tio års erfarenhet. Photodermatol Photoimmunol Photomed. (1999) 15:3–4.,
PubMed Abstract | Google Scholar
37. Mastalier U, Kerl H, Wolf P. Clinical laboratory, phototest and phototherapy findings in polymorphic light eruptions: a retrospective study of 133 patients. Eur J Dermatol. (1998) 8:554–9.
PubMed Abstract | Google Scholar
38. Krutmann J, Morita A. Mechanisms of ultraviolet (UV) B and UVA phototherapy. J Invest Dermatol Symp Proc. (1999) 4:70–2.,
PubMed Abstract | Google Scholar
39. Janssens AS, Pavel S, Out-Luiting JJ, Willemze R, de Gruijl FR. Normalized ultraviolet (UV) induction of Langerhans cell depletion and neutrophil infiltrates after artificial UVB hardening of patients with polymorphic light eruption. Br J Dermatol. (2005) 152:1268–74. doi: 10.1111/j.1365-2133.2005.06690.x
PubMed Abstract | CrossRef Full Text | Google Scholar
40., Varg P, Gruber-Wackernagel En, Bambach jag, Schmidbauer U, Mayer G, Absenger M, et al. Photohardening av polymorfa ljusutbrott patienter minskar baseline epidermal Langerhans celldensitet samtidigt öka mastcellantal i papillär dermis. Exp Dermatol. (2014) 23:428–30. doi: 10.1111/exd.12427
PubMed Abstract | CrossRef Full Text | Google Scholar
42. Schwarz En, Navid F, Sparwasser T, Clausen VARA, Schwarz T., 1,25-dihydroxyvitamin D exerts similar immunosuppressive effects as UVR but is dispensable for local UVR-induced immunosuppression. J Invest Dermatol. (2012) 132, 2762–9. doi: 10.1038/jid.2012.238
PubMed Abstract | CrossRef Full Text | Google Scholar
43. Norris PG, Hawk JL. Successful treatment of severe polymorphous light eruption with azathioprine. Arch Dermatol. (1989) 125:1377–9.
PubMed Abstract | Google Scholar