det finns fyra lagar, kända som gaslagar, som beskriver hur gaser beter sig. De fyra lagarna är Boyles lag, Charles lag, Gay-Lussacs lag och Avogadros lag.
Charles lag
Jacques Charles, en fransk fysiker, upptäckte på 1780-talet att uppvärmning av en gas kommer att få den att expandera med en viss bråkdel. Bilden nedan visar hur tillsättning av värme gör molekyler rör sig snabbare och träffar sidorna och locket med större kraft, vilket flyttar locket upp när gasen expanderar.,
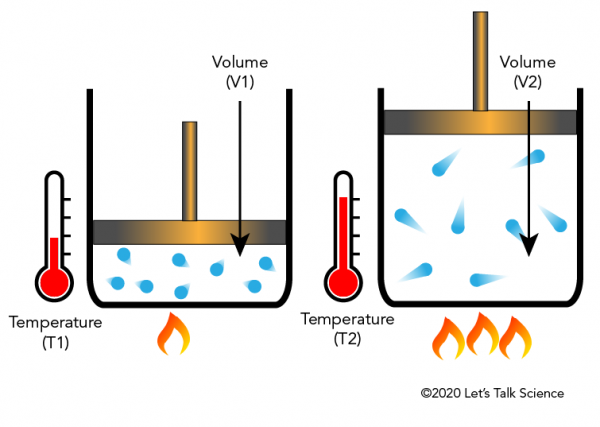
Charles’ lag i vardagen
för att göra en luftballonghöjning läggs värme till luften inuti ballongen. Att tillsätta Värme gör att molekylerna rör sig längre bort från varandra.

i vardagligt språk skulle vi säga att luften inuti expanderar. När detta händer minskar ballongens totala densitet (massa per volymenhet) och luften inuti den. När ballongens densitet minskar för att vara mindre än densiteten hos uteluften stiger ballongen. Omvänt kommer volymen av en gas att krympa om temperaturen minskar.
nedan kan du se flytande kväve som hälls över en grön ballong. Det kalla flytande kvävet kyler luften inuti ballongen., Som ett resultat saktar luftmolekylerna ner, vilket gör att ballongens volym minskar.

under semestern kan någon du känner ha använt en kalkontermometer. En kalkontermometer fastnar i kalkon medan den lagar mat och dyker sedan upp när köttet är tillräckligt kokt. Hur fungerar denna underbara bit av teknik? Det har att göra med Charles lag, naturligtvis!, Inuti kalkontermometern är en liten mängd luft. När temperaturen stiger inuti Kalkon expanderar luften inuti kalkontermometern. När den når en viss volym dyker toppen och berättar kocken att kalkon är ordentligt kokad.

Gay-Lussacs lag
Joseph Louis Gay-Lussac var en fransk kemist och fysiker som upptäckte 1802 att om du håller volymen av en gaskonstant (som i en sluten behållare), och du applicerar värme, ökar trycket på gasen. Detta beror på att gaserna har mer kinetisk energi, vilket får dem att slå behållarens väggar med mer kraft (vilket resulterar i större tryck).
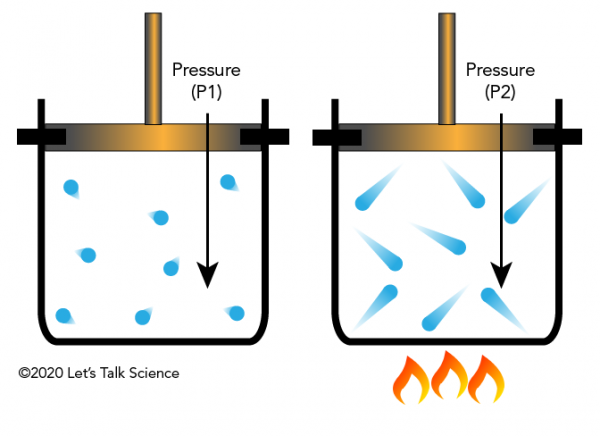
Gay-Lussacs lag i vardagen
inuti en tryckkokare sitter maten du vill laga i vatten. När temperaturen på det flytande vattnet ökas produceras vattenånga (vatten i dess gastillstånd). Denna ånga kan inte undgå tryckkokaren-vilket innebär att volymen inte ändras. Vattenångans tryck fortsätter att öka tills vattentemperaturen och vattenångan överskrider den normala kokpunkten för vatten (100 °C). Vid denna högre temperatur kan mat kokas mycket snabbare., Tufft kött kommer också ut mycket mer ömt efter att ha kokats i en tryckkokare.

visste du att lufttrycket på insidan av bildäck ändras när bilen körs? Efter körning går lufttrycket i bilens däck upp. Detta beror på att friktion (en kontaktkraft) mellan däcken och vägen gör att luften inuti däcken värms upp., Luften kan inte expandera eftersom däcken i huvudsak är en fast volymbehållare, så trycket ökar – det här är Gay-Lussacs lag!