inlärningsmål
- känna till de fysikaliska egenskaperna hos joniska och molekylära ämnen.
det fysikaliska tillståndet och egenskaperna hos en viss förening beror till stor del på vilken typ av kemisk bindning den visar., Molekylära föreningar, ibland kallade 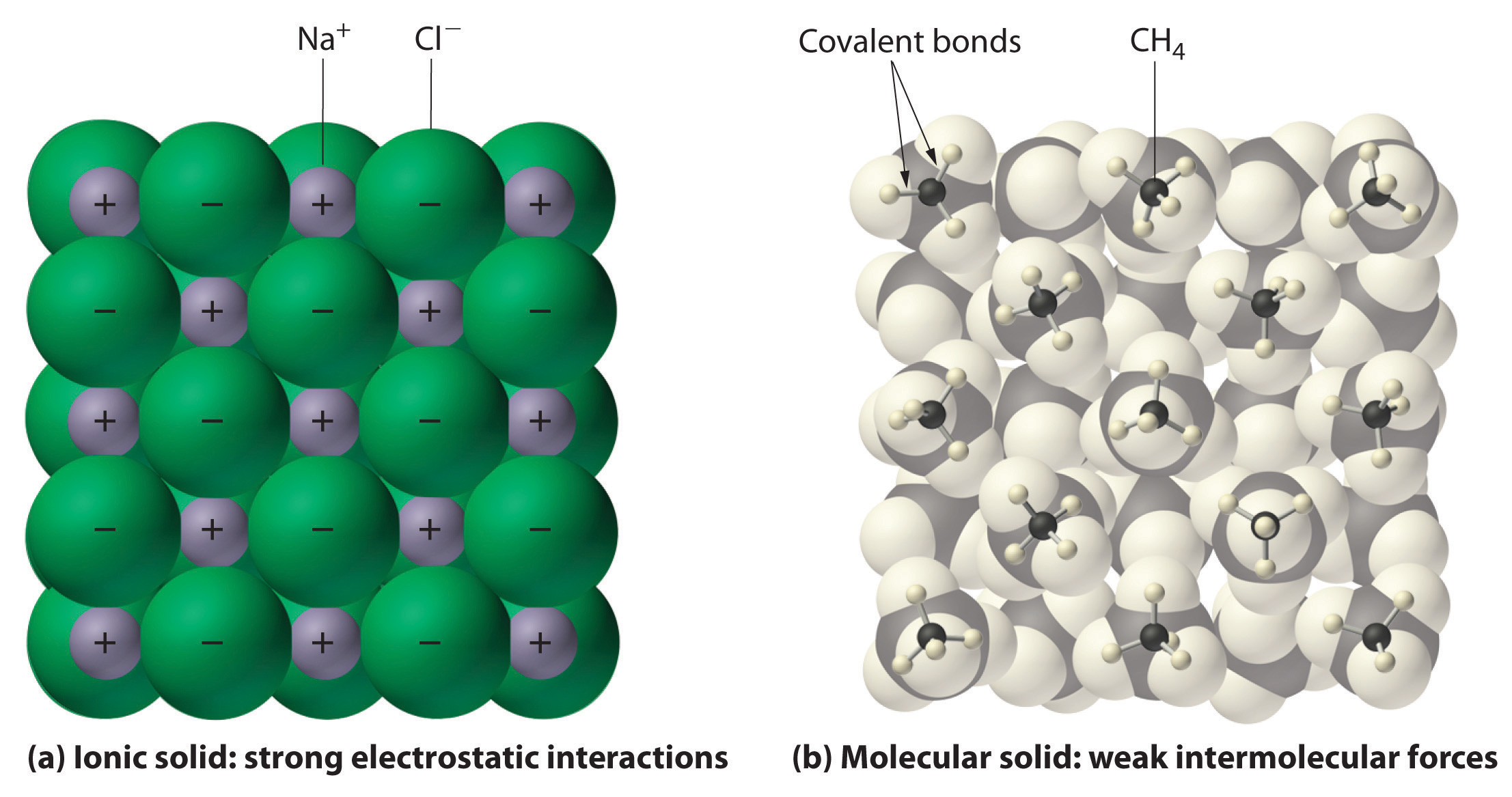 kovalenta föreningar, visar ett brett spektrum av fysikaliska egenskaper på grund av olika typer av intermolekylära attraktioner såsom olika typer av polära interaktioner. Smältpunkterna och kokpunkterna för molekylära föreningar är i allmänhet ganska låga jämfört med de av joniska föreningar. Detta beror på att den energi som krävs för att störa de intermolekylära krafterna mellan molekyler är mycket mindre än den energi som krävs för att bryta jonbindningarna i en kristallin jonisk förening (figur \(\PageIndex{1}\)) ., Joniska fasta ämnen smälter vanligtvis vid höga temperaturer och kokar vid ännu högre temperaturer. Till exempel smälter natriumklorid vid 801 ° C och kokar vid 1413 °C. (Som jämförelse smälter det molekylära föreningens vatten vid 0 °C och kokar vid 100 °C.). Vattenlösligheten hos molekylära föreningar är variabel och beror främst på vilken typ av intermolekylära krafter som är involverade.
kovalenta föreningar, visar ett brett spektrum av fysikaliska egenskaper på grund av olika typer av intermolekylära attraktioner såsom olika typer av polära interaktioner. Smältpunkterna och kokpunkterna för molekylära föreningar är i allmänhet ganska låga jämfört med de av joniska föreningar. Detta beror på att den energi som krävs för att störa de intermolekylära krafterna mellan molekyler är mycket mindre än den energi som krävs för att bryta jonbindningarna i en kristallin jonisk förening (figur \(\PageIndex{1}\)) ., Joniska fasta ämnen smälter vanligtvis vid höga temperaturer och kokar vid ännu högre temperaturer. Till exempel smälter natriumklorid vid 801 ° C och kokar vid 1413 °C. (Som jämförelse smälter det molekylära föreningens vatten vid 0 °C och kokar vid 100 °C.). Vattenlösligheten hos molekylära föreningar är variabel och beror främst på vilken typ av intermolekylära krafter som är involverade.
figur \(\PageIndex{1}\) interaktioner i Joniska och kovalenta fasta ämnen.,
(a) de positivt och negativt laddade jonerna i ett jonskt fast ämne såsom
natriumklorid (NaCl) hålls samman av starka elektrostatiska interaktioner.
(b) i denna representation av packningen av metan (CH4) molekyler i fast metan,
en prototypisk molekylär fast substans, metanmolekylerna hålls samman
i fast ämne endast av relativt svaga intermolekylära krafter, även om
atomerna inom varje metanmolekyl hålls samman av starka kovalenta bindningar.,
eftersom molekylära föreningar består av neutrala molekyler är deras elektriska ledningsförmåga i allmänhet ganska dålig, vare sig i fast eller flytande tillstånd. I fast form är en jonisk förening inte elektriskt ledande eftersom dess joner inte kan strömma (”el” är flödet av laddade partiklar). När smält kan det emellertid leda elektricitet eftersom dess joner kan röra sig fritt genom vätskan (figur \(\PageIndex{2}\); Video \(\Pageindex{1}\)).,

figur \(\Pageindex{2}\) natriumklorid smälter vid 801 °C och leder elektricitet när smält. (credit: modification of work by Mark Blaser and Matt Evans)
konduktivitet av smält Salt
Video \(\Pageindex{1}\) titta på den här videon för att se en blandning av salter smälta och leda elektricitet.
tabellen nedan sammanfattar några av skillnaderna mellan joniska och molekylära föreningar.,>
vattenlöslighet
en typ av Molekylär compound beter sig ganska annorlunda än det som hittills beskrivits., Ett kovalent nätverk fast är en förening där alla atomer är anslutna till varandra genom kovalenta bindningar. Diamond består helt av kolatomer, var och en bundna till fyra andra kolatomer i en tetraedrisk geometri. Smältning av ett kovalent nätverk solid uppnås inte genom att övervinna de relativt svaga intermolekylära krafterna. Snarare måste alla kovalenta bindningar brytas, en process som kräver extremt höga temperaturer. Diamant smälter faktiskt inte alls. Istället förångas den till en gas vid temperaturer över \(3500^\text{o} \text{C}\).,
sammanfattning
- materialets fysikaliska egenskaper påverkas av de intermolekylära krafter som håller molekylerna samman.
- joniska föreningar bildar vanligtvis hårda kristallina fasta ämnen med höga smältpunkter. Kovalenta molekylära föreningar består däremot av diskreta molekyler som hålls samman av svaga intermolekylära krafter och kan vara gaser, vätskor eller fasta ämnen vid rumstemperatur och tryck.
- joniska föreningar i smält form eller i lösning kan leda elektricitet medan molekylära föreningar inte gör det..,
Bidragsgivare
-
Marisa Alviar-Agnew (Sacramento City College)
-
Paul Blommor (University of North Carolina – Pembroke), Klaus Theopold (University of Delaware) och Richard Langley (Stephen F. Austin State University) med att bidra författare. Läroboksinnehåll som produceras av OpenStax College är licensierat under en Creative Commons Attribution License 4.0-licens. Ladda ner gratis på http://cnx.org/contents/85abf193-2bd…[email protected]).,
-
CK-12 Grund av Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, och Jean Dupon.