Um breve resumo do Processo de Haber
O Processo de Haber combina nitrogênio do ar com o hidrogênio, principalmente derivados de gás natural (metano) em amônia. A reação é reversível e a produção de amônia é exotérmica.,
![]()
![]()
Um fluxo de regime para o Processo de Haber parecido com este:
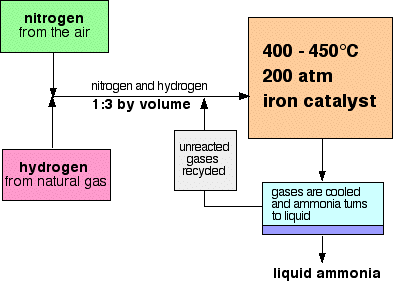
Algumas observações sobre as condições
O catalisador
O catalisador, na verdade, é um pouco mais complicado do que o ferro puro. Tem hidróxido de potássio adicionado como promotor – uma substância que aumenta a sua eficiência.
a pressão
a pressão varia de uma fábrica para outra, mas é sempre elevada. Você não pode ir muito longe em um exame citando 200 atmosferas.,Reciclagem
Reciclagem
em cada passagem dos gases através do reactor, apenas cerca de 15% do azoto e do hidrogénio convertem-se em amoníaco. (Esta figura também varia de planta para planta.) Por reciclagem contínua do nitrogênio e hidrogênio, a conversão global é de cerca de 98%.
Explicando as condições
As proporções de nitrogênio e hidrogênio
A mistura de nitrogênio e hidrogênio vai para o reator é na proporção de 1 volume de nitrogênio para 3 volumes de hidrogênio.,a Lei de Avogadro diz que volumes iguais de gases à mesma temperatura e pressão contêm números iguais de moléculas. Isso significa que os gases estão indo para o reator na razão de 1 molécula de nitrogênio para 3 de hidrogênio.esta é a proporção exigida pela equação.
em algumas reacções poderá optar por utilizar um excesso de um dos reagentes. Você faria isso se fosse particularmente importante usar tanto quanto possível o outro reagente-se, por exemplo, fosse muito mais caro. Isso não se aplica neste caso.,
Há sempre um lado para baixo para usar qualquer coisa que não as proporções da equação. Se você tem um excesso de um reagente haverá moléculas passando pelo reator que não podem reagir porque não há nada com o qual eles possam reagir. Este desperdício de espaço do reator-particularmente espaço na superfície do catalisador.
a temperatura
considerações de equilíbrio
é necessário deslocar a posição do equilíbrio tanto quanto possível para a direita, a fim de produzir a quantidade máxima possível de amoníaco na mistura de equilíbrio.,a reacção à frente (produção de amoníaco) é exotérmica.
![]()
![]()
de acordo com o princípio de Le Chatelier, isto será favorecido se você baixar a temperatura. O sistema responderá movendo a posição de equilíbrio para neutralizar isso – em outras palavras, produzindo mais calor.
A fim de obter o máximo de amônia possível na mistura de equilíbrio, você precisa de uma temperatura o mais baixa possível. No entanto, 400 – 450°C não é uma temperatura baixa!,quanto mais baixa a temperatura que usa, mais lenta a reacção se torna. Um fabricante está tentando produzir o máximo de amônia possível por dia. Não faz sentido tentar alcançar uma mistura de equilíbrio que contenha uma proporção muito elevada de amoníaco se levar vários anos para a reacção atingir esse equilíbrio.é necessário que os gases atinjam o equilíbrio no curto espaço de tempo que estarão em contacto com o catalisador no reactor.,
O Compromisso
400 – 450°C é uma temperatura de compromisso produzindo uma proporção razoavelmente alta de amônia na mistura de equilíbrio (mesmo que seja apenas 15%), mas em um tempo muito curto.
A pressão
Equilíbrio considerações
![]()
![]()
Aviso de que há 4 moléculas no lado esquerdo da equação, mas só 2 à direita.,de acordo com o princípio de Le Chatelier, se aumentar a pressão, o sistema responderá favorecendo a reacção que produz menos moléculas. Isso fará com que a pressão caia novamente.
A fim de obter o máximo de amônia possível na mistura de equilíbrio, você precisa de uma pressão tão alta quanto possível. 200 atmosferas é uma alta pressão, mas não incrivelmente alta.o aumento da pressão aproxima as moléculas., Neste caso específico, aumentarão as suas hipóteses de bater e permanecer na superfície do catalisador onde possam reagir. Quanto maior a pressão melhor em termos da taxa de uma reação de gás.considerações económicas as pressões muito elevadas são muito dispendiosas para produzir em dois aspectos.você tem que construir tubos extremamente fortes e recipientes de contenção para suportar a pressão muito alta. Isso aumenta seus custos de capital quando a planta é construída.as altas pressões custam muito para produzir e manter., Isso significa que os custos de funcionamento de sua planta são muito elevados.
O Compromisso
200 atmosferas é uma pressão de compromisso escolhida por razões económicas. Se a pressão usada for demasiado elevada, o custo de gerá-la excede o preço que você pode começar para o amoníaco extra produzido.
o catalisador
considerações de equilíbrio
O catalisador não tem qualquer efeito sobre a posição do equilíbrio. Adicionar um catalisador não produz uma maior percentagem de amônia na mistura de equilíbrio. Sua única função é acelerar a reação.,na ausência de um catalisador, a reação é tão lenta que praticamente nenhuma reação acontece em qualquer tempo sensível. O catalisador garante que a reação é rápida o suficiente para que um equilíbrio dinâmico seja estabelecido no curto espaço de tempo que os gases estão realmente no reator.
separando o amoníaco
Quando os gases saem do reator estão quentes e a uma pressão muito elevada., Amônia é facilmente liquefeito sob pressão, desde que não seja muito quente, e assim a temperatura da mistura é baixada o suficiente para que a amônia se transforme em um líquido. O nitrogênio e o hidrogênio permanecem como gases mesmo sob essas altas pressões, e podem ser reciclados.
Perguntas para testar o seu conhecimento
Se este é o primeiro conjunto de perguntas que você tem feito, por favor, leia a página de introdução antes de começar. Você vai precisar usar o botão de trás no seu navegador para voltar aqui depois.,
questions on the Haber Process
answers
onde você gostaria de ir agora?
no menu de equilíbrio . . .
no menu de Química Física . . .
para o Menu principal . . .