Nucleophilic Substituição do Grupo Hidroxila
O comportamento químico de halogenetos de alquilo pode ser usado como uma referência na descoberta de análogo de substituição e de eliminação, reações de álcoois. A principal diferença, é claro, é uma mudança no ânion deixando de haleto para hidróxido. Como o oxigênio é ligeiramente mais eletronegativo do que o cloro (3.5 vs. 2.8 na escala de Pauling), a ligação C-O é esperada para ser mais polar do que uma ligação C-Cl., Além disso, uma medida independente das características eletrofílicas dos átomos de carbono a partir de suas mudanças químicas NMR (tanto prótons de 13C quanto Alfa) indica que o oxigênio e os substituintes de cloro exercem uma influência similar de retirada de elétrons quando ligados a átomos de carbono hibridizados sp3. Apesar desta evidência promissora de fundo, os álcoois não sofrem as mesmas reações SN2 comumente observadas com haletos de alquilo. Por exemplo, a reação rápida de SN2 de 1-bromobutano com cianeto de sódio, mostrada abaixo, não tem paralelo quando 1-butanol é tratado com cianeto de sódio., Na verdade, o álcool etílico é muitas vezes usado como um solvente para reações de substituição de haleto de alquilo como este.
CH3CH2CH2CH2–Br + An(+) CN(–)  CH3CH2CH2CH2–CN + An(+) Br(–)
CH3CH2CH2CH2–CN + An(+) Br(–)
CH3CH2CH2CH2–OH + Na(+) CN(–)  Nenhuma Reação
Nenhuma Reação
O fator chave aqui é a estabilidade das deixando ânion (brometo vs. hidróxido)., HBr é um ácido muito mais forte do que a água (por mais de 18 ordens de magnitude), e esta diferença é refletida em reações que geram suas respectivas bases conjugadas. A base mais fraca, brometo, é mais estável, e sua liberação em uma reação de substituição ou eliminação é muito mais favorável do que a do íon hidróxido, uma base mais forte e menos estável.
Um passo claro na direção de melhorar a reatividade dos álcoois em reações SN2 seria modificar o –OH do grupo funcional de uma forma que melhora sua estabilidade como deixar o anião., Uma dessas modificações é conduzir a reação de substituição em um ácido forte, convertendo-OH para-OH2 (+). Como o íon hidrônio (H3O (+)) é um ácido muito mais forte do que a água, sua base conjugada (H2O) é um grupo de saída melhor do que o íon hidróxido. O único problema com esta estratégia é que muitos nucleófilos, incluindo o cianeto, são desativados por protonação em ácidos fortes, efetivamente removendo o co-reagente nucleofílico necessário para a substituição., Os ácidos fortes HCl, HBr e HI não estão sujeitos a esta dificuldade porque suas bases conjugadas são bons nucleófilos e são bases ainda mais fracas do que álcoois. As equações a seguir ilustram algumas reações de substituição de álcoois que podem ser afetados por esses ácidos. Tal como acontece com os haletos de alquilo, a substituição nucleofílica de 1 ° -álcoois procede por um mecanismo SN2, enquanto 3 ° -álcoois reagem por um mecanismo SN1. Reações de 2 ° – álcoois podem ocorrer por ambos os mecanismos e muitas vezes produzem alguns produtos rearranjados., Os números entre parênteses ao lado das fórmulas de ácido mineral representam a percentagem ponderal de uma solução aquosa concentrada, a forma na qual estes ácidos são normalmente utilizados.
embora estas reacções sejam por vezes referidas como” catalisadas pelo ácido”, isto não é estritamente correcto. Na transformação geral, um ácido HX forte é convertido em água, um ácido muito fraco, então pelo menos uma quantidade estequiométrica de HX é necessária para uma conversão completa do álcool em haleto de alquilo., A necessidade de usar quantidades equivalentes de ácidos muito fortes nesta reação limita a sua utilidade para álcoois simples do tipo mostrado acima. Os álcoois com grupos sensíveis ao ácido não toleram, naturalmente, esse tratamento. No entanto, a ideia de modificar o grupo funcional-OH para melhorar a sua estabilidade como um ânion de saída pode ser perseguida em outras direções. O diagrama seguinte mostra algumas modificações que se revelaram eficazes. Em cada caso, o grupo hidroxilo é convertido em um éster de um ácido forte. Os dois primeiros exemplos mostram os ésteres de sulfonato descritos anteriormente., O terceiro e quarto exemplos mostram a formação de um éster de fosfito (X representa os restantes bromo ou substituintes alcoólicos adicionais) e um éster de clorossulfito, respectivamente. Todos estes grupos de saída (Azul Colorido) têm ácidos conjugados que são muito mais fortes do que a água (por 13 a 16 potências de dez); assim, o ânion de saída é correspondentemente mais estável do que o íon hidróxido. Os compostos de mesilato e tosilato são particularmente úteis porque podem ser usados em reações de substituição com uma grande variedade de nucleófilos., Os intermediários produzidos em reações de álcoois com tribrometo de fósforo e cloreto de tionilo (dois últimos exemplos) são raramente isolados, e essas reações continuam a produzir brometo de alquilo e produtos de cloreto.
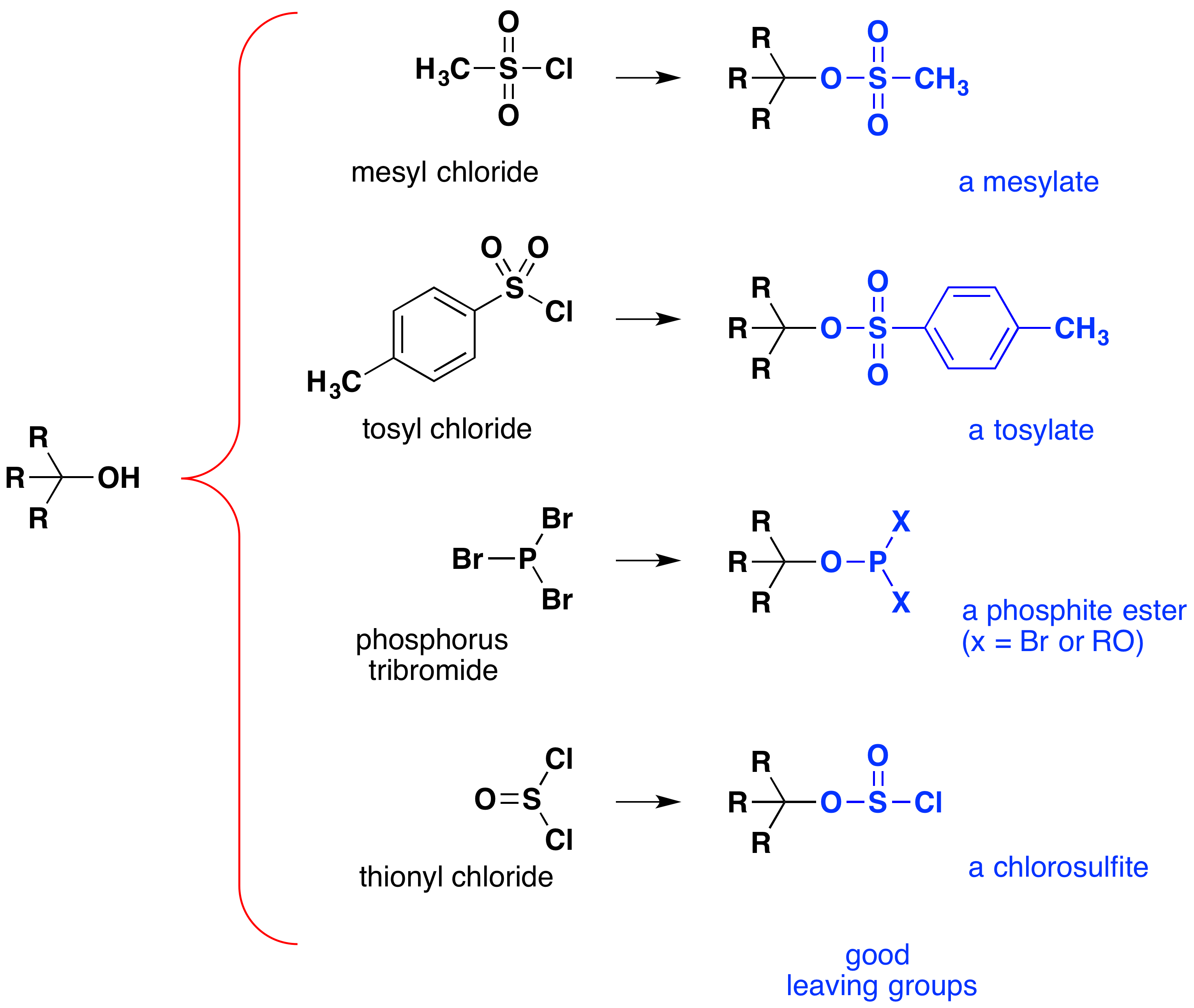
A importância de sulfonato de éster de intermediários em geral nucleophilic substituição de reações de álcoois pode ser ilustrado pelo seguinte conversão de 1-butanol a pentanenitrile (butil cianeto), uma reação que não ocorre com o álcool sozinho., Por outro lado, o fósforo e os halogenetos de tionilo actuam apenas para converter álcoois nos halogenetos de alquilo correspondentes.,
| CH3CH2CH2CH2–OH + CH3SO2Cl | pyridine
|
CH3CH2CH2CH2–OSO2CH3 | Na(+) CN(–)
|
CH3CH2CH2CH2–CN + CH3SO2O(–) Na(+) |
Some examples of alcohol substitution reactions using this approach to activating the hydroxyl group are shown in the following diagram., Os dois primeiros casos servem para reforçar o fato de que os derivados de ésteres de sulfonato de álcoois podem substituir haletos de alquilo em uma variedade de reações SN2. Os dois casos seguintes demonstram o uso de tribrometo de fósforo na conversão de álcoois em brometos. Este reagente pode ser utilizado sem base adicionada (por exemplo, piridina), uma vez que o produto Ácido fosforoso é um ácido mais fraco do que o HBr. Tribrometo de fósforo é melhor usado com 1º-álcoois porque 2º-álcoois muitas vezes produzem rearranjo de subprodutos resultantes de reações concorrentes SN1., Note que o oxigênio éter na reação 4 não é afetado por este reagente, enquanto que a síntese alternativa usando HBR concentrado clives éteres. O tricloreto de fósforo (PCl3) converte álcoois em cloretos de alquilo de forma semelhante, mas o cloreto de tionilo é geralmente preferido para esta transformação porque os produtos inorgânicos são gases (SO2 & HCl). Triiodeto de fósforo não é estável, mas pode ser gerado in situ a partir de uma mistura de fósforo vermelho e iodo e age para converter álcoois em iodetos de alquilo., O último exemplo mostra a reacção do cloreto de tionilo com um álcool quiral 2º. A presença de uma base orgânica como piridina é importante porque fornece uma concentração substancial de íon cloreto necessária para a reação final SN2 do intermediário clorosufita., Na ausência de uma base, chlorosufites se decompor após o aquecimento para produzir o esperado cloreto de alquil com retenção de configuração
álcoois Terciários não são comumente usados para a substituição de reações do tipo discutido aqui porque SN1 e E1 reação caminhos são dominantes e são de difícil controle.

A importância de sulfonato de ésteres como intermediários em muitas reações de substituição não pode ser exagerada., Uma prova rigorosa da inversão configuracional que ocorre no local de substituição em reações SN2 faz uso de tais reações. Um exemplo de tal prova é mostrado abaixo. Abreviaturas para os derivados sulfonilicos mais comumente usados são dadas na tabela seguinte.
| Sulfonil Grupo | CH3SO2– | CH3C6H4SO2– | BrC6H4SO2– | CF3SO2– |
|---|---|---|---|---|
| Nome & Abbrev., | Mesyl ou Ms | Tosyl ou Ts | Brosyl ou Bs | Trifyl ou Tf |
Inversão de Prova

Para uma discussão mais completa da hidroxila reações de substituição e uma descrição de outros seletiva métodos para esta transformação, Clique Aqui.
contribuidores
- William Reusch, Professor Emérito (Michigan State U.,), Virtual Textbook of Organic Chemistry