Introdução
Durante o inverno, às vezes dermatologistas receber pacientes assintomáticos, sem lesões de outros que, talvez, alguns pós-inflamatória descoloração, mas com uma necessidade desesperada por ajuda. Eles começam a contar a história de uma série de pápulas ou vesículas aparecendo em sua pele após a primeira exposição intensa do sol do ano., Junto com as lesões, uma terrível comichão começa e aumenta com a propagação da doença, após a próxima exposição solar, por vezes agravada por uma espécie de sensação de queimadura. No entanto, estas pessoas são modelos sun seekers e continuam a desfrutar do sol durante todo o verão, esperando que as pápulas para gradualmente desaparecer e desaparecer. As principais questões são: como posso evitar isso? Porque estou a ter este problema desde ” 5 ” anos agora, mas nunca o tive antes?,
estamos muito provavelmente lidando com erupção de luz polimórfica (PLE) e, seguindo as solicitações de nossos pacientes, a pesquisa médica tem sido focada principalmente em estratégias de prevenção tornam-se hoje bastante satisfatória. Por outro lado, a segunda e certamente menos explorada questão permanece incerta, a menos que várias peças tenham sido adicionadas a este quebra-cabeça bastante complicado. O objectivo desta breve revisão é retomar os progressos mais recentes nos mecanismos possíveis e nos protocolos mais utilizados para a prevenção ou o tratamento.
patofisiologia da erupção da luz polimórfica: o que há de novo?,
PLE é a doença fotossensível mais comum, caracterizada por uma erupção intermitente de pápulas eritematosas, vesículas ou placas não cicatrizantes (Figura 1) que se desenvolvem dentro de horas de exposição à radiação ultravioleta (UVR) da pele do paciente. A doença depende da susceptibilidade genética, bem como do componente ambiental, como o tipo de exposição. A PLE parece agrupar-se em famílias: estima-se que a prevalência de PLE foi de 21 e 18% em gêmeos monozigóticos e dizigóticos, respectivamente (1)., Além disso, uma história familiar positiva de PLE em parentes de primeiro grau estava presente em 12% dos pares gêmeos afetados em relação a 4% dos pares gêmeos não afetados (p < 0.0001). A concordância probandwise no monozigótico foi superior à dos pares gémeos dizigóticos (0, 72 vs. 0, 30, respectivamente), demonstrando um forte efeito genético (1). Muitos genes de potencial interesse na patogênese da PLE têm sido investigados com resultados geralmente não-relacionados., Utilizando a análise da segregação, estimou-se que 72% da população do Reino Unido possui um alelo de susceptibilidade por PLE de baixa penetração (2).
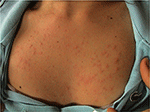
a Figura 1. Quadro clínico da erupção da luz polimórfica numa jovem.
a falha da apoptose: os possíveis antigénios Neo Fotoinduzidos
numa análise recente da expressão genómica, apenas 16 genes foram expressos diferencialmente entre a PLE e os controlos saudáveis após irradiação UV em relação ao controlo (3)., Destes genes, 14 mostraram expressão mais baixa em pacientes com PLE, enquanto dois resultaram sobre-expressados. Entre os 14 genes com menor expressão em PLE são: complemento 1 subunidade (C1s), scavenger receptor B1 (SCARB1) fibronectina (FN1), imunoglobulina superfamily membro 3 (IGSF3), caspase-1 (CASP1) e paraoxonase 2 (PON2), todos os genes associados com apoptótico de células de folga. Foi suposto que a modificação proteica durante a depuração das células apoptóticas pode levar à potencial formação de auto-antigénio (4)., Em seguida, a expressão reduzida em pacientes por PLE de genes conectados a este processo pode representar uma possível fonte de auto-antígeno, bem como uma fase crucial no início do processo auto-imune que promove a doença (3). De acordo com estas conclusões, Kuhn et al. demonstrou acumulação de células apoptóticas em doentes com PL irradiados com 1, 5 dose mínima de eritema (MED) de UVB, ou 60-100 J/cm2 de UVA1, em comparação com os controlos (5).,imunidade: a falha da tolerância
Auto-antigénios derivados da eliminação ineficiente de células apoptóticas, são provavelmente absorvidos por células dendríticas (DCs) e apresentados a células T ingénuas (citotóxicas e auxiliares) posteriormente transformadas em células T auto-reactivas (6, 7). Esta falha parcial da apoptose contribui, juntamente com a imunossupressão inadequada após a exposição aos UV, para o reconhecimento e apresentação do antigénio, levando à manifestação clínica típica dos doentes com PLE (8)., De facto, a falência da imunossupressão normal induzida pelo UVR foi provada como a principal anomalia imunológica na por, explicada, inicialmente, pela permanência das células de Langerhans (LCs) na epiderme. Esta sobre-ativação do sistema imunológico, que escapa à tolerância funcional induzida pelos UV, é provavelmente responsável pela redução da prevalência de câncer de pele em pacientes com PLE (9). Por outro lado, o mesmo mecanismo é culpado pela falha da supressão da dermatite de contacto alérgica (ACD), após exposição UVR (10).,
via inflamatória: reacção de hipersensibilidade de tipo retardado
os mecanismos imunológicos envolvidos na PLE, com mediadores do sistema imunitário inato e adaptativo, são muito semelhantes, quer do ponto de vista histológico quer bioquímico, aos mecanismos ACD. Com efeito, no início dos anos setenta, Epstein indicou pela primeira vez a PLE como uma reacção de hipersensibilidade de tipo retardado (DTHR) ao antigénio cutâneo indefinido induzido pela UVR (11). Recentemente, para reforçar este conceito, alguns dos mediadores inflamatórios envolvidos na ACD foram demonstrados também em PLE., Por exemplo, a família IL-1 (12, 13), um grupo crescente de citocinas que desempenham vários papéis na regulação imunitária e inflamação (14), envolvida também na patogênese ACD (12, 15), foi explorada também em PLE (16). IL-36α e IL-36γ, os membros pró-inflamatórios da família IL-1 foram aumentados em PLE no que diz respeito aos controlos, como para as amostras ACD, mas IL-36γ foi muito melhorado em PLE do que em ACD (16). Agindo através comum receptor composto de IL-36R e IL-1R/AcP (IL-1RL2), IL-36α, IL-36β, e IL-36γ ativar o NF-kB e MAPKs, promovendo reações inflamatórias., O aumento de IL-36s na pele e no sangue periférico de doentes com PLE indica a activação da resposta imunitária local e sistémica, tal como encontrada em múltiplas condições inflamatórias cutâneas (15, 17, 18). Provavelmente, a ligação entre a exposição IL-36s e UVR é representada pelo sinal pró-inflamatório de activação do receptor toll like (TLR)-3, devido à libertação de ARN pelos queratinócitos necróticos (19). De fato, a falha da liberação apoptótica em PLE, com abundância de detritos celulares, pode ser responsável por uma amplificação deste “sinal de alerta”.,”
além disso, IL-36s poderia contribuir para amplificar o sinal imune inato e a consequente cascata inflamatória, promovendo peptídeos antimicrobianos (AMPs) (20).
Inflamatória: Amplificadores e Microbiano
Como amplamente examinada em vários processos inflamatórios da pele, estes mediadores, nomeado como defensinas (α e β), cathelicidin (LL37), ribonuclease 7 (RNase7) e psoriasin (S100A7), em face do desequilíbrio induzido pela radiação uv em queratinócitos e pele microbiano, também têm sido investigados em PLE (21, 22). Patra et al., descobriram que a expressão de psoriasina, RNase7, HBD-2, e LL-37 foi aumentada na pele PLE lesional, enquanto HBD-3 foi diminuída. Considerando a superfície da pele como um “mundo multiétnico”, sem esquecer o papel crucial dos queratinócitos, não podemos excluir que a libertação de AMPs possa ser determinada pela modificação nos componentes microbiológicos após a interação UV (23). De facto, o microbioma pode representar a fonte, directa ou indirecta, dos antigénios UVR ainda não detectados formados em doentes por PLE, o que conduz a lesões queratinocitárias., Como consequência, o LL-37, também induzido pela UVB, IFNy, TNF-α, IL-6, pode representar um potencial condutor indirecto do PLE (23). Pode formar agregados com ácidos auto-nucleicos capazes de ativar pDCs: na psoríase foi reconhecido como o principal autoantigeno (24). Embora em doentes com PLE tenha sido notificada uma ausência completa de pcs (25), existe um meio auto-imune, e o LL-37 pode desempenhar um papel fundamental, induzindo outras vias inflamatórias. Na figura S1 (material suplementar), os conceitos expressos acima são visualizados em um desenho animado.terapia da erupção da luz polimórfica: o que há de novo?,
a primeira linha de tratamento para a por inclui a prevenção do sol, protectores solares e corticosteróides tópicos (26). Para todos os doentes, a gestão preventiva é fundamental durante o tempo de sol, evitando a exposição intensa ao UVR e a utilização de vestuário de protecção, bem como a aplicação de Protector solar, em particular durante a primeira exposição do ano. Os protectores solares de largo espectro de nova geração, com elevado factor de Protecção solar para UVB (SPF), juntamente com uma protecção UVA de comprimento de onda mais longo, têm sido notificados como conferindo protecção total ou parcial em até 90% dos doentes com PLE (27, 28)., A utilização de antioxidantes orais e nicotinamida pode representar uma medida preventiva adicional válida para estes doentes. Os efeitos benéficos da nicotinamida foram investigados num ensaio não controlado de 42 doentes, em que 60% deles notificaram a supressão completa dos sintomas ao tomar 2-3 g de nicotinamida diariamente, antes da exposição solar (29). Além disso, demonstrou-se que um extracto do polipodiumleucotomo de feto tropical [PL) exerce efeitos antioxidantes potentes e imunomoduladores., Quando administrado a 480 mg / dia antes da exposição solar, reduziu significativamente as reacções cutâneas e os sintomas subjectivos (30, 31). No que diz respeito aos corticosteróides tópicos, mesmo que não tenham sido realizados ensaios para determinar a sua eficácia na Por, são amplamente utilizados para reduzir a comichão (26). A segunda linha de tratamentos para a por inclui corticosteróides sistémicos e terapêutica com foto(quimio) (26). Num ensaio aleatorizado, em dupla ocultação, controlado com placebo (32), Os autores sugeriram a utilização diária de 25 mg de prednisolona durante 4-5 dias no início da erupção., Embora devam ser considerados os potenciais efeitos secundários a longo prazo de ciclos repetidos de prednisolona, pode ser aconselhado para os doentes que sofrem de ataques ocasionais de PL, na ausência de quaisquer contra-indicações. Em casos mais leves de PLE, um programa de auto-condicionamento por exposição graduada à luz solar na primavera pode ser suficiente (33). Considerando que, em casos mais graves, o tratamento de condicionamento/dessensibilização sob supervisão médica pode ser mais apropriado., Um curso de terapia psoraleno e UVA (PUVA), banda estreita (NB)-UVB ou fototerapia de banda larga (BB)-UVB, geralmente administrado no início da primavera, pode ser eficaz, bem como tratamento profilático (26). O protocolo de tratamento consiste geralmente num ciclo de fototerapia/fotocemoterapia durante 5-6 semanas. As doses iniciais dependem da dose mínima de eritema (MED) ou da dose mínima fototóxica (MPD), sendo frequentemente 50-70% destes limiares medidos com aumentos incrementais., Para manter o benefício adquirido com a terapia de dessensibilização, uma exposição solar regular durante todo o verão é aconselhável, caso contrário o endurecimento pode ser perdido dentro de 4-6 semanas. No tratamento da PLE, NB-UVB deve ser preferido ao PUVA (força da recomendação D; nível de evidência 4), devido ao menor risco de fotocarcinogénese, sem risco de náuseas ou outros efeitos secundários associados à ingestão de MOP, e sem necessidade de utilizar protecção ocular pós-tratamento. No entanto, o PUVA deve ser considerado, antes de outros tratamentos sistémicos, se o NB-UVB tiver falhado ou tiver anteriormente despoletado a erupção., Com efeito, tal como descrito abaixo, a eficácia foi demonstrada para múltiplos regimes de fototerapia (BB-UVB, NB-UVB e PUVA), e os efeitos secundários, em termos de provocação de erupção cutânea, eritema e comichão foram considerados mais comuns com UVB do que com PUVA (34). Como resumido, na literatura, a eficácia do PUVA resulta numa taxa de fotoprotecção de 65-100% (34)., Foram realizados vários estudos comparativos, mas a partir do único ensaio controlado aleatorizado entre PUVA e NB-UVB mais comprimidos de placebo, três vezes por semana, durante 5 semanas, não surgiu diferença significativa na eficácia, considerando a ocorrência de Por ou restrição da actividade ao ar livre (35). In the 10 years retrospective review, reported by Man et al. (36) 170 doentes com LME moderada a grave receberam fototerapia PUVA e/ou UVB. Em detalhe, 8 doentes receberam PUVA, 128 NB-UVB, 5 BB-UVB e 29 doentes, que não responderam satisfatoriamente a NB-UVB, receberam PUVA no ano seguinte., Foram feitas auto-avaliações da gravidade e a frequência dos episódios de PLE foi reportada nas visitas de acompanhamento no outono ou durante a primavera seguinte. Foi notificada uma melhoria boa ou moderada em 88% dos doentes tratados com PUVA e em 89% dos doentes tratados com UVB. Dos doentes tratados com PUVA e NB-UVB, a maioria preferiu o PUVA. Num outro estudo retrospectivo de 14 anos em 79 doentes tratados com fototerapia (37), a eficácia, medida durante o verão seguinte em termos de fotoprotecção com remissão completa/parcial, foi de 65% para o PUVA, 82% para o BB-UVB e 83% para o UVA em monoterapia., Neste caso, o tratamento com PUVA foi reservado para formas PLE mais graves.os mecanismos pelos quais a fototerapia induz a fotoprotecção não são totalmente compreendidos.
no entanto, nos últimos anos, muitos avanços foram realizados. Para além dos efeitos bem conhecidos sobre a melaninização e o espessamento epidérmico da fototerapia, são notificadas várias propriedades imunomodulatórias e anti-inflamatórias induzidas pelos UV (38)., Tanto a UVB como a UVA modulam a expressão da molécula de adesão e induzem mediadores solúveis, tais como a hormona estimulante de melanócitos, a IL-10 (que suprime a produção de interferão γ) e a prostaglandina E2, que explicitam acções anti-inflamatórias, impedem a activação das células T e promovem a apoptose das células T infiltradas na pele (34). Além disso, foi demonstrado que o fotoardenamento profilático por UV em doentes com poro restabelece a migração da CL induzida pela UV da epiderme para os gânglios linfáticos drenantes da pele: um dos principais acontecimentos celulares na imunossupressão UV-(39)., A tolerância induzida pela CL é mediada pela libertação da citoquina imunossupressora, como a IL-10, e pela interferência com a maturação e indução das células T reguladoras (Tregs) (40). Além disso, recentemente, foi relatada uma ligação interessante entre LC, Tregs e vitamina D3. Com efeito, foi demonstrado que um pré-tratamento tópico de curta duração de 1 semana com o análogo 1,25-dihidroxivitamina D, calcipotriol, diminuiu os sintomas da PLE após a fotoprovocação experimental subsequente (41)., Além disso, num estudo Murino, 1, 25-dihidroxivitamina D demonstrou efeitos imunossupressores comparáveis aos da UV (42). Outro crosstalk interessante foi destacado entre LCs e mastócitos. Além de seu papel reconhecido na atopia, mastócitos dérmicos também são responsáveis por proteger a pele da inflamação induzida pelo UVB, promovendo imunossupressão UV (40). Estudos em seres humanos demonstraram que, após a exposição aguda e crónica ao UVR, o número de mastócitos dérmicos aumenta, juntamente com a libertação de IL-10., Em geral, estes dados sugerem um papel potencial para mastócitos em PLE, e no mecanismo de fotoordenamento. De acordo com isto, Wolf et al. relataram, pela primeira vez, que o fotoardening aumenta significativamente a densidade das células do mastro na derme papilar dos doentes com PLE (40). Resumindo, o photohardening funciona na PLE, restaurando a via imuno-supressiva normal UV, envolvendo vários tipos de células. O tratamento de terceira linha para a por inclui o uso de fármacos imunossupressores sistémicos, tais como azatioprina e ciclosporina., No entanto, apenas casos esporádicos de doentes tratados com sucesso são notificados na literatura (43, 44). Além disso, a hidroxicloroquina, os ácidos gordos ómega-3 e o beta-caroteno foram propostos como tratamentos, mas são necessários mais ensaios controlados, duplamente cegos e aleatórios, para avaliar realmente a sua eficácia clínica.uma vez que a elevada prevalência e o aumento da incidência de lle, associado ao desconforto e às restrições do estilo de vida, são necessários estudos futuros para encontrar novas estratégias terapêuticas e/ou preventivas., A escolha do tratamento por PLE apropriado requer um bom conhecimento do curso clínico individual da doença, juntamente com a possibilidade de realizar phototest. Alguns aspectos novos na possível ativação e promoção do processo inflamatório foram destacados.,
Para o estado actual do conhecimento, apesar da identificação de alguns crucial celular regulamento envolvidos na restauração da tolerância imunológica, é difícil tirar conclusões definitivas sobre a eficácia de vários potenciais tratamentos em PLE, devido à falta de estudos adequados e a dificuldade em avaliar medidas de resultado. A pontuação clínica para avaliar a gravidade da por (PLESI) (45) continua a ser um instrumento pouco utilizado e restringido principalmente a fins de investigação., O estudo mais profundo dos mecanismos patogenéticos subjacentes da desordem permitirá uma abordagem de tratamento mais orientada.
contribuições do autor
SL projetou o manuscrito, selecionou o material para o papel, escreveu o rascunho inicial e corrigiu os seguintes rascunhos do manuscrito. AR estava envolvido na escrita do manuscrito, apoiando novas ideias de Conteúdo e estilo.,
Declaração de conflito de interesses
os autores declaram que a investigação foi realizada na ausência de quaisquer relações comerciais ou financeiras que possam ser interpretadas como um potencial conflito de interesses.
material suplementar
figura s1. Interplay between inate and adaptive immune system in a context of apoptosis failure in the epiderme. Psoriasina: expressão abundante em camadas espinhosas e granulares de pele de PLE. (Símbolo azul) RNase7: expresso principalmente em queratinócitos do estrato granuloso e do estrato córneo de lesões por PLE., (Símbolo amarelo) LL-37 foi profundamente expresso em e em torno dos vasos sanguíneos e glândulas em PLE. Queratinócitos apoptóticos com uma clearance ineficiente.,hic light eruption; ACD, Allergic contact dermatitis; DTHR, Delayed type hypersensitivity reaction; UVR, Ultraviolet radiation; C1s, Complement 1s subunit; SCARB1, Scavenger receptor B1; FN1, Fibronectin; IGSF3, Immunoglobulin superfamily member 3; CASP1, Caspase-1; PON2, Paraoxonase 2; MED, Minimal Erythema Dose; DCs, Dendritic cells; LCs, Langerhans cells; TLR, Toll like receptor; AMPs, Antimicrobial peptides; SPF, Sun protection factor; PUVA, Psoralen and UVA therapy; NB-UVB, Narrowband; BB-UVB, Broadband UVB; MPD, Minimum phototoxic dose; Tregs, Regulatory T cells; PL, Polypodiumleucotomos.,
2. McGregor JM, Grabczynska S, Vaughan R, Hawk JL, Lewis CM. Genetic modelling of abnormal photosensitivity in families with polymorphic light eruption and actinic prurigo. J Invest Dermatol. (2000) 115:471–6. doi: 10.1046/j.1523-1747.2000.00080.x
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Lembo S, Hawk JLM, Murphy GM, Kaneko K, Young AR, McGregor JM, et al., Aberrant gene expression with deficient apoptotic keratinocyte clearance may predispose to polymorphic light eruption. Br J Dermatol. (2017) 177:1450–3. doi: 10.1111/bjd.15200
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Savill J, Fadok V. Corpse clearance defines the meaning of cell death. Nature (2000) 407:784–8. doi: 10.,1038/35037722
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Kuhn A, Herrmann M, Kleber S, Beckmann-Welle M, Fehsel K, Martin-Villalba A, et al. Accumulation of apoptotic cells in the epidermis of patients with cutaneous lupus erythematosus after ultraviolet irradiation. Arthritis Rheum. (2006) 54:939–50. doi: 10.1002/art.21658
PubMed Abstract | CrossRef Full Text | Google Scholar
6., Savill J, Dransfield I, Gregory C, Haslett C. A blast from the past: clearance of apoptotic cells regulates immune responses. Nat RevImmunol. (2002) 2:965–75. doi: 10.1038/nri957
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Albert ML, Sauter B, Bhardwaj N. Dendritic cells acquire antigen from apoptotic cells and induce class I-restricted CTLs. Nature (1998) 392:86–9. doi: 10.,1038/32183
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Koulu LM, Laihia JK, Peltoniemi HH, Jansén CT. UV-induced tolerance to a contact allergen is impaired in polymorphic light eruption. J Invest Dermatol. (2010) 130:2578–82. doi: 10.1038/jid.2010.181
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Epstein JH. Polymorphous light eruption. J Am Acad Dermatol. (1980) 3:329–43.,
PubMed Abstract | Google Scholar
12. Mattii M, Ayala F, Balato N, Filotico R, Lembo S, Schiattarella M, et al. The balance between pro- and anti-inflammatory cytokines is crucial in human allergic contact dermatitis pathogenesis: the role of IL-1 family members. Exp Dermatol. (2013) 22:813–9. doi: 10.1111/exd.12272
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Dinarello CA., Interleucina – 1 na patogénese e no tratamento de doenças inflamatórias. Blood (2011) 117:3720-32. doi: 10.1182/sangue-2010-07-273417
PubMed Resumo | CrossRef Texto Completo | Google Scholar
16. Lembo S, Caiazzo G, Balato N, Monfrecola G, Patra V, Wolf P, et al. Erupção de luz polimórfica e membros da família IL-1: alguma diferença com dermatite de contacto alérgica? Photochem Photobiol Sci. (2017) 16:1471–9. doi: 10.,1039/c7pp00142h
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Balato A, Schiattarella M, Lembo S, Mattii M, Prevete N, Balato N, et al. Interleukin-1 family members are enhanced in psoriasis and suppressed by vitamin D and retinoic acid. Arch Dermatol Res. (2013) 305:255–62. doi: 10.1007/s00403-013-1327-8
PubMed Abstract | CrossRef Full Text | Google Scholar
19., Borkowski AW, Kuo IH, Bernard JJ, Yoshida T, Williams MR, Hung NJ. A activação do receptor 3 semelhante à portagem é necessária para a reparação normal da barreira cutânea após danos UV. J. Invest Dermatol. (2015) 135:569–78. doi: 10.1038 / jid.2014.354
PubMed Resumo | CrossRef Texto Completo | Google Scholar
20. Li n, Yamasaki K, Saito R, Fukushi-Takahashi S, Shimada-Omori R, Asano M, et al. Função da alamina do peptídeo antimicrobiano catelicidina LL37 através da indução IL-36γ nos queratinócitos epidérmicos humanos. J Imunol., (2014) 193:5140–8. doi: 10.4049/jimmunol.1302574
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Patra V, Wolf P. Microbial elements as the initial triggers in the pathogenesis of polymorphic light eruption? Exp Dermatol. (2016) 25:999–1001. doi: 10.1111/exd.13162
PubMed Abstract | CrossRef Full Text | Google Scholar
22., Gläser R, Navid F, Schuller W, Jantschitsch C, Harder J, Schröder JM, et al. A radiação UV-B induz a expressão de peptídeos antimicrobianos nos queratinócitos humanos in vitro e in vivo. J Alergia Imunol Clin. (2009) 123:1117–23. doi: 10.1016 / j. jaci.2009.01.043
PubMed Resumo | CrossRef Texto Completo | Google Scholar
23. Patra V, Mayer G, Gruber-Wackernagel A, Horn M, Lembo S, Wolf P., Perfil único da expressão do peptídeo antimicrobiano em lesões com erupções polimórficas ligeiras em comparação com pele saudável, dermatite atópica e psoríase. Photodermatol Photoimmunol Photomed. (2018) 34:137–44. doi: 10.1111/phpp.12355
PubMed Resumo | CrossRef Texto Completo | Google Scholar
25. Schweintzger na, Gruber-Wackernagel a, Shirsath N, Quehenberger F, Obermayer-Pietsch B, Wolf P. Influence of the seasons on vitamin D levels and regulatory T cells in patients with polymorphic light eruption., Photochem Photobiol Sci. (2016) 15:440–6. doi: 10.1039/c5pp00398a
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Proby C, Baker C, Morton O, Hawk JLM. New broad spectrum sunscreen for polymorphic light eruption. Lancet (1993) 341:1347–8.
PubMed Abstract | Google Scholar
28. Allas S, Lui H, Moyal D, Bissonnette R., Comparação da capacidade de 2 protectores solares para proteger contra a erupção da luz polimórfica induzida por uma lâmpada de halogeneto metálico UV-a/UV-B. Arch Dermatol. (1999) 135:1421–2.
PubMed Resumo | Google Scholar
29. Ortel B, Wechdorn D, Tanew a, Honigsmann H. Effect of nicotinamide on the phototest reaction in polymorphous lighteruption. Br J Dermatol. (1988) 118:669–73.
PubMed Resumo | Google Scholar
30., Caccialanza M, Percivalle S, Piccinno R, Brambilla R. Photoprotective activity of oral Polypodiumleucotomos extract in 25 patients with idiopathic photodermatoses. Photodermatol Photoimmunol Photomed. (2007) 23:46–7. doi: 10.1111/j.1600-0781.2007.00274.x
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Tanew A, Radakovic S, Gonzalez S, Venturini M, Calzavara-Pinton P. Oral administration of a hydrophilic extract of Polypodiumleucotomos for the prevention of polymorphic light eruption., J Am Acad Dermatol. (2012) 66:58–62. doi: 10.1016/j.jaad.2010.09.773
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Van Praag MCG Boom, BW, Vermeer BJ. Diagnosis and treatment of polymorphous light eruption. Int J Dermatol. (1994) 33:233–9.
Google Scholar
34. Ling TC, Clayton TH, Crawley J, Exton LS, Goulden V, Ibbotson S, et al., British association of dermatologists and british photodermatology group guidelines for the safe and effective use of psoralen-ultraviolet a therapy 2015. Br J Dermatol. (2016) 174:24–55. doi: 10.1111 / bjd.14317
PubMed Resumo | CrossRef Texto Completo | Google Scholar
36. Man I, Dawe RS, Ferguson J. Artificial hardening for polymorphic light eruption: practical points from ten years ‘ experience. Photodermatol Photoimmunol Photomed. (1999) 15:3–4.,
PubMed Abstract | Google Scholar
37. Mastalier U, Kerl H, Wolf P. Clinical laboratory, phototest and phototherapy findings in polymorphic light eruptions: a retrospective study of 133 patients. Eur J Dermatol. (1998) 8:554–9.
PubMed Abstract | Google Scholar
38. Krutmann J, Morita A. Mechanisms of ultraviolet (UV) B and UVA phototherapy. J Invest Dermatol Symp Proc. (1999) 4:70–2.,
PubMed Abstract | Google Scholar
39. Janssens AS, Pavel S, Out-Luiting JJ, Willemze R, de Gruijl FR. Normalized ultraviolet (UV) induction of Langerhans cell depletion and neutrophil infiltrates after artificial UVB hardening of patients with polymorphic light eruption. Br J Dermatol. (2005) 152:1268–74. doi: 10.1111/j.1365-2133.2005.06690.x
PubMed Abstract | CrossRef Full Text | Google Scholar
40., Wolf P, Gruber-Wackernagel A, Bambach I, Schmidbauer U, Mayer G, Absenger M, et al. O fotoardeamento de doentes com erupção polimórfica da luz diminui a densidade celular epidérmica inicial de Langerhans, ao mesmo tempo que aumenta o número de mastócitos na derme papilar. Exp Dermatol. (2014) 23:428–30. D. N.: 10.1111 / exd.12427
PubMed Resumo | CrossRef Texto Completo | Google Scholar
42. Schwarz a, Navid F, Sparwasser T, Clausen BE, Schwarz T., 1,25-dihydroxyvitamin D exerts similar immunosuppressive effects as UVR but is dispensable for local UVR-induced immunosuppression. J Invest Dermatol. (2012) 132, 2762–9. doi: 10.1038/jid.2012.238
PubMed Abstract | CrossRef Full Text | Google Scholar
43. Norris PG, Hawk JL. Successful treatment of severe polymorphous light eruption with azathioprine. Arch Dermatol. (1989) 125:1377–9.
PubMed Abstract | Google Scholar