Existem quatro leis, conhecidas como Leis do gás, que descrevem como os gases se comportam. As quatro leis são a Lei de Boyle, a Lei de Charles, A Lei de Gay-Lussac e a Lei de Avogadro.Jacques Charles, um físico francês, descobriu na década de 1780 que o aquecimento de um gás fará com que ele se expanda por uma certa fração. A imagem abaixo mostra como a adição de calor faz com que as moléculas se movam mais rapidamente e atinjam os lados e a tampa com maior força, movendo assim a tampa para cima à medida que o gás se expande.,
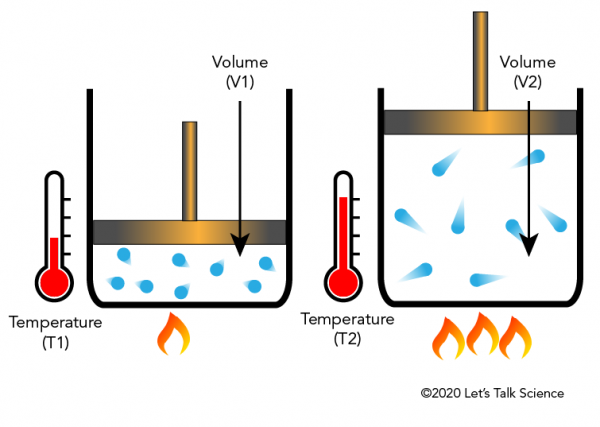
Charles’ Law in Everyday Life
In order to make a hot air balloon rise, heat is added to the air inside the balloon. A adição de calor faz com que as moléculas se afastem mais umas das outras.

na linguagem corrente, diríamos que o ar interior se expande. Quando isso acontece, a densidade total (massa por unidade de volume) do balão e o ar dentro dele diminui. Quando a densidade do balão diminui para ser menor que a densidade do ar exterior, o balão sobe. Inversamente, o volume de um gás diminuirá se sua temperatura diminuir. abaixo pode ver o nitrogénio líquido a ser derramado sobre um balão verde. O nitrogênio líquido frio arrefece o ar dentro do balão., Como resultado, as moléculas de ar diminuem fazendo com que o volume do balão diminua.

Durante as férias, alguém que você conhece pode ter usado um turquia termômetro. Um termômetro de peru é preso no peru enquanto ele cozinha e então aparece quando a carne é cozinhada o suficiente. Como é que esta maravilhosa peça de tecnologia funciona? Tem a ver com a Lei do Charles, claro!, Dentro do termômetro Peru está uma pequena quantidade de ar. À medida que a temperatura sobe dentro do Peru, o ar dentro do termómetro Perú expande-se. Uma vez que atinge um certo volume, o topo estoura, dizendo ao chef que o peru é devidamente cozinhado.

Gay-Lussac, Lei de
Joseph Louis Gay-Lussac foi um químico francês e físico descoberto em 1802, que se você manter o volume de um gás constante (como em um recipiente fechado), e aplicar o calor, a pressão do gás irá aumentar. Isto porque os gases têm mais energia cinética, fazendo com que atinjam as paredes do recipiente com mais força (resultando em maior pressão).
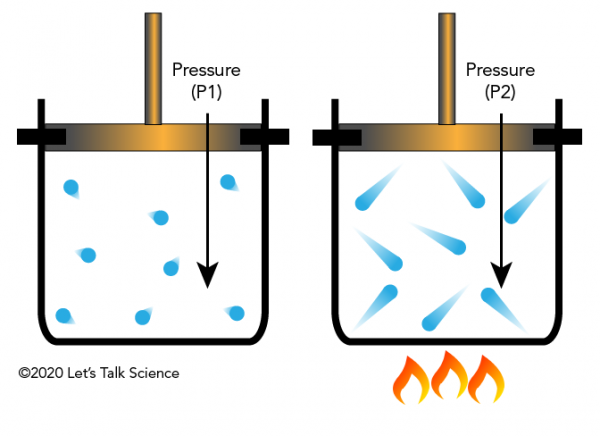
Gay-Lussac’s Law in Everyday Life
Inside a pressure cooker the food that you want to cook sits in water. À medida que a temperatura da água líquida aumenta, produz-se vapor de água (água no seu estado gasoso). Este vapor não pode escapar da panela de pressão – o que significa que o volume não está a mudar. A pressão do vapor de água continua a aumentar até que a temperatura da água e do vapor de água ultrapassem o ponto de ebulição normal da água (100 °C). A esta temperatura mais alta, os alimentos podem ser cozinhados muito mais rápido., A carne dura também sai muito mais tenra depois de ser cozinhada numa panela de pressão.

sabia que a pressão do ar no interior dos pneus do carro muda quando o carro é conduzido? Depois de conduzir, a pressão de ar nos pneus de um carro sobe. Isto porque a fricção (uma força de contato) entre os pneus e a estrada faz com que o ar dentro dos pneus para aquecer., O ar não pode se expandir porque os pneus são essencialmente um contêiner de volume fixo, então a pressão aumenta-esta é a Lei de Gay – Lussac!