os Átomos e a Energia da Luz
O estudo dos átomos e suas características se sobrepõem vários differentsciences. Químicos, físicos e astrônomos todos devem entender a escala temicroscópica na qual grande parte do universo funciona, a fim de ver a “imagem maior”.,
Dentro do Átomo
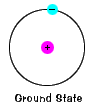 |
O estado fundamental de um elétron, o nível de energia itnormally ocupa, é o estado de menor energia para o elétron. |
| existe também uma energia máxima que cada electrão pode ter e ainda fazer parte do seu átomo. Além dessa energia, o elétron não está mais ligado ao núcleo do átomo e é considerado ionizado., | 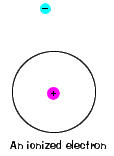 |
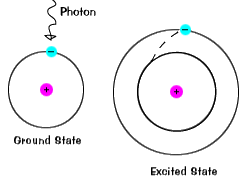 |
Quando um elétron ocupa temporariamente um estado de energia maior do que itsground estado, ele está em um estado excitado.Um elétron pode tornar-se entusiasmado se ele é dado de energia extra, como se itabsorbs um fóton, ou o pacote de luz, ou colide com a proximidade de um átomo ou partícula. |
a Energia da Luz
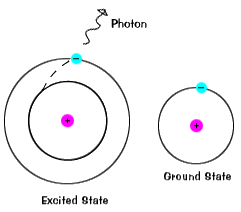 |
Elétrons não permanecer em animado estados por muito tempo – eles soonreturn para a sua terra estados, emitindo um fotão com a sameenergy como a que foi absorvida., |
a Identificação de diferentes Tipos de Átomos
as Transições entre os vários orbitais são únicos para cada elemento, porque theenergy níveis são exclusivamente determinada por prótons e nêutrons no thenucleus. Sabemos que diferentes elementos têm diferentes números de prótons e nêutrons em seus núcleos. Quando os electrões de um certo átomo regressam a órbitas inferiores de estados excitados, os fótons que emitem têm energias que são características desse tipo de átomo., Isto dá a eachelement uma impressão digital única, tornando possível identificar os elementospresentes em um recipiente de gás, ou mesmo uma estrela.
Podemos usar ferramentas como a tabela periódica de elementos para descobrir exatamente como muitos prótons, e, portanto, elétrons, um átomo tem. Em primeiro lugar, sabemos que para um átomo ter uma carga neutra, deve ter o mesmo número de protões e electrões. Se um átomo perde ou ganha electrões, torna-se ionizado ou carregado. A tabela periódica nos dará o número atômico de um elemento. O número atómico diz-nos quantos protões e atomhas., Por exemplo, o hidrogênio tem um número atômico de um – o que significa que tem um próton e, portanto, um elétron – e na verdade não tem nêutrons.
para o estudante
baseado na descrição anterior do átomo, Desenhe amodel do átomo de hidrogénio. O modelo” padrão ” de um átomo é knownas o modelo de Bohr.
formas Diferentes do mesmo elemento químico, que diferem apenas pelo número de nêutrons no seu núcleo são chamados de isótopos. A maioria dos elementos tem mais do que um isótopo natural., Muitos outros isótopos foram produzidos em reatores nucleares e laboratórios científicos. Os isótopos usualmente não são muito estáveis, e tendem a sofrer decaimento radioativo até que algo que é mais estável é formado. Você pode estar familiarizado com o elementuranium – ele tem vários isótopos instáveis, U-235 sendo um dos mais conhecidos com frequência. O 235 significa que esta forma de urânio tem 235 neutrões e protões combinados. Se procurarmos o número atómico do urânio e o subtraímos de 235, podemos calcular o número de neutrões que o isótopo tem.,
Aqui está outro exemplo-o carbono geralmente ocorre na forma de C-12 (carbono-12), ou seja, 6 prótons e 6 nêutrons, embora um isótopo seja C-13, com 6protons e 7 nêutrons.
para o estudante
Use a tabela periódica e os nomes dos elementos indicados abaixo para descobrir quantos prótons, nêutrons e elétrons eles têm.Desenhar um modelo de átomo do seguinte elemento: silício-28, magnésio-24, enxofre-32, oxigénio-16 e hélio-4.,
para o estudante
usando o texto, defina os seguintes termos: níveis de energia, absorção, emissão, estado excitado, estado de solo,ionização, átomo, elemento, massa atómica, número atómico, isótopo.
Um Opcional Nota sobre a Mecânica Quântica Natureza dos ÁtomosEnquanto o átomo de Bohr descrito acima é um bom wayto aprender sobre a estrutura dos átomos, não é a forma mais correta de tomodel-los., embora cada orbital tenha uma energia precisa, o elétron é agora imaginado como sendo espalhado em uma “nuvem de elétrons”em torno do núcleo. É comum falar da distância média para thecloud como o raio do elétron da órbita.Então lembre-se, nós vamos manter as palavras “órbita” e “orbital”, embora nós arenow usando-os para descrever não uma televisão plano orbital, mas aregion onde um elétron tem uma probabilidade de ser.os elétrons são mantidos perto do núcleo por atração elétrica entre o núcleo e os elétrons.,Mantido lá da mesma forma que os nove planetas ficam perto do Sol em vez de irradiar a galáxia. Ao contrário do sistema solar, onde todas as órbitas dos planetas estão no mesmo plano, as órbitas de elétrons são mais tridimensionais. Cada nível de energia num átomo tem uma forma diferente. Há consequências matemáticas que te dirão a probabilidade da localização do electrão nessa órbita. vamos considerar o átomo de hidrogênio, do qual já desenhamos um modelo de Bohr.,
o texto e as imagens desta secção foram adaptados da página de Dave Slaven no átomo (ver referências abaixo). |

