objectivos de aprendizagem
- Conhecer as propriedades físicas das substâncias iónicas e moleculares.
o estado físico e as propriedades de um determinado composto dependem em grande parte do tipo de ligação química que exibe., Compostos moleculares, às vezes chamado de 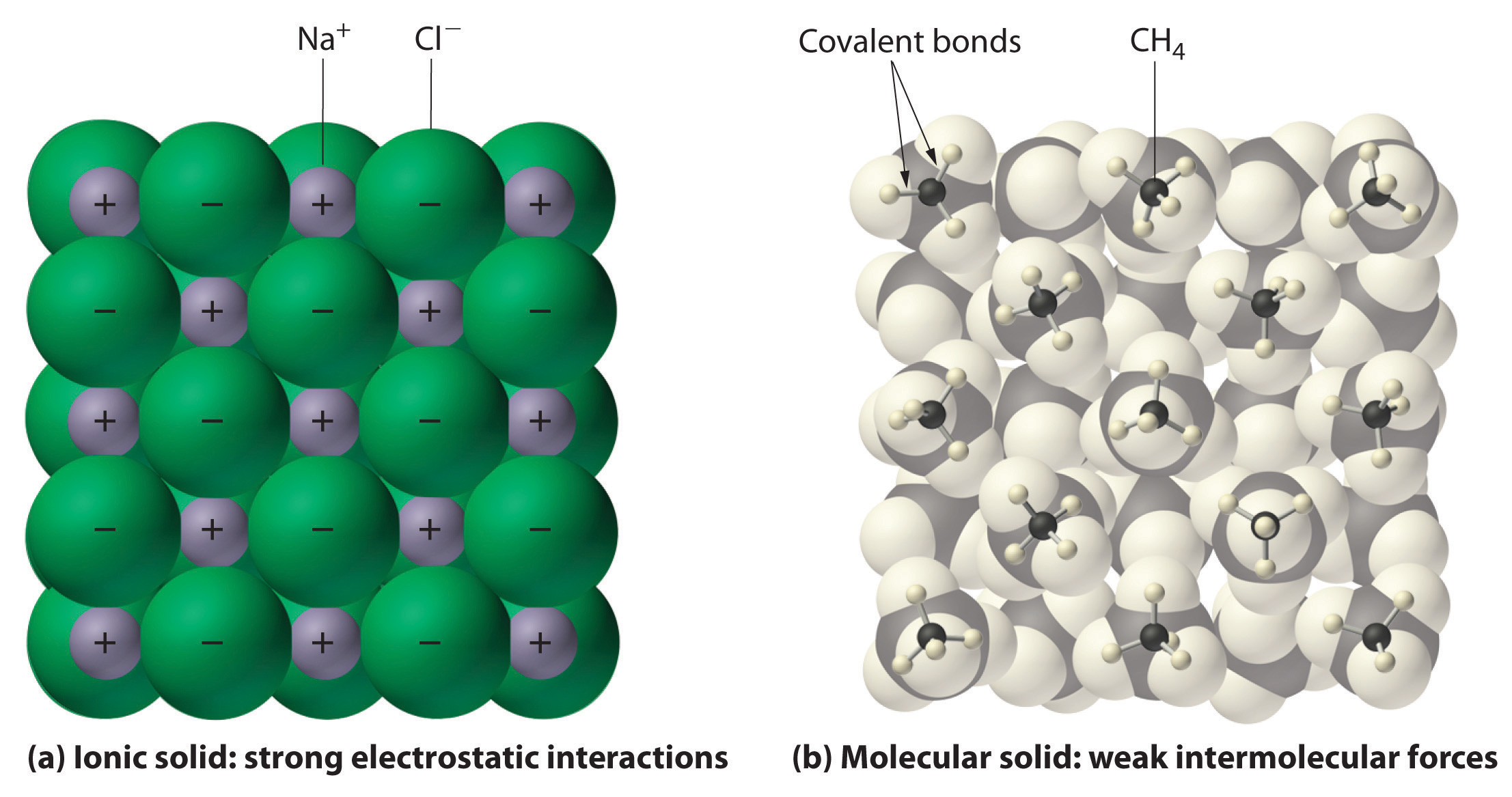 covalente compostos, apresentar uma ampla gama de propriedades físicas devido aos diferentes tipos de atrações intermoleculares, tais como diferentes tipos de interações polares. Os pontos de fusão e ebulição dos compostos moleculares são geralmente bastante baixos em comparação com os compostos iônicos. Isto porque a energia necessária para interromper as forças intermoleculares entre moléculas é muito menor do que a energia necessária para quebrar as ligações iônicas em um composto iônico cristalino (figura \(\PageIndex{1}\)) ., Os sólidos iónicos derretem tipicamente a altas temperaturas e fervem a temperaturas ainda mais elevadas. Por exemplo, o cloreto de sódio derrete a 801 °C e ferve a 1413 °C. (Em comparação, a água do composto molecular derrete a 0 °C e ferve a 100 °C.). A solubilidade em água dos compostos moleculares é variável e depende principalmente do tipo de forças intermoleculares envolvidas.
covalente compostos, apresentar uma ampla gama de propriedades físicas devido aos diferentes tipos de atrações intermoleculares, tais como diferentes tipos de interações polares. Os pontos de fusão e ebulição dos compostos moleculares são geralmente bastante baixos em comparação com os compostos iônicos. Isto porque a energia necessária para interromper as forças intermoleculares entre moléculas é muito menor do que a energia necessária para quebrar as ligações iônicas em um composto iônico cristalino (figura \(\PageIndex{1}\)) ., Os sólidos iónicos derretem tipicamente a altas temperaturas e fervem a temperaturas ainda mais elevadas. Por exemplo, o cloreto de sódio derrete a 801 °C e ferve a 1413 °C. (Em comparação, a água do composto molecular derrete a 0 °C e ferve a 100 °C.). A solubilidade em água dos compostos moleculares é variável e depende principalmente do tipo de forças intermoleculares envolvidas.
figura \(\PageIndex{1}\) interacções em sólidos iónicos e covalentes.,
(a) os iões carregados positiva e negativamente num sólido iónico como o cloreto de sódio (NaCl) são mantidos juntos por fortes interacções electrostáticas. nesta representação das moléculas de metano (CH4) no metano sólido, as moléculas de metano são mantidas juntas no sólido apenas por forças intermoleculares relativamente fracas, embora os átomos dentro de cada molécula de metano sejam mantidos unidos por fortes ligações covalentes.,uma vez que os compostos moleculares são compostos de moléculas neutras, sua condutividade elétrica é geralmente muito pobre, seja no estado sólido ou líquido. Na forma sólida, um composto iônico não é eletricamente condutor porque seus íons são incapazes de fluir (“eletricidade” é o fluxo de partículas carregadas). Quando fundido, no entanto, pode conduzir electricidade porque os seus íons são capazes de se mover livremente através do líquido (figura \(\PageIndex{2}\); vídeo \(\PageIndex{1}\)).,

figura \(\PageIndex{2}\) O cloreto de sódio derrete a 801 °C e conduz a electricidade quando fundido. (crédito: modificação de trabalho por Mark Blaser e Matt Evans)
de Condutividade de sais
o Vídeo de \(\PageIndex{1}\) Assista a este vídeo para ver uma mistura de sais de derretimento e de conduzir eletricidade.a tabela abaixo resume algumas das diferenças entre compostos iónicos e moleculares.,>
solubilidade em Água
Um tipo de composto molecular comporta-se de forma bastante diferente do que o descrito até agora., Um sólido de rede covalente é um composto no qual todos os átomos estão conectados um ao outro por ligações covalentes. Diamond is composed entirely of carbon atoms, each bonded to four other carbon atoms in a tetrahedral geometry. Derreter um sólido de rede covalente não é realizado superando as forças intermoleculares relativamente fracas. Pelo contrário, todas as ligações covalentes devem ser quebradas, um processo que requer temperaturas extremamente altas. O diamante, na verdade, não derrete nada. Em vez disso, vaporiza para um gás a temperaturas acima de \(3500^\text{O} \text{c}\).,
resumo
- as propriedades físicas de um material são afectadas pelas forças intermoleculares que mantêm as moléculas Unidas.os compostos iónicos formam geralmente sólidos cristalinos duros com pontos de fusão elevados. Compostos moleculares covalentes, em contraste, consistem em moléculas discretas mantidas juntas por forças intermoleculares fracas e podem ser gases, líquidos ou sólidos à temperatura ambiente e pressão.os compostos iónicos em forma derretida ou em solução podem produzir electricidade, enquanto os compostos moleculares não o fazem..,
Contribuintes
-
Marisa Alviar-Agnew (Sacramento City College)
-
Paulo Flores (Universidade da Carolina do Norte – Pembroke), Klaus Theopold (Universidade de Delaware (eua) e Richard Langley (Stephen F. Austin State University), com autores. Textbook content produced by OpenStax College is licensed under a Creative Commons Attribution License 4.0 license. Download gratuito em http://cnx.org/contents/85abf193-2bd…[email protected]).,CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.