atomen en lichtenergie
De studie van atomen en hun kenmerken overlappen verschillende wetenschappen. Scheikundigen, natuurkundigen en astronomen moeten allen de microscopische schaal begrijpen waarop een groot deel van het universum functioneert om het “grotere plaatje”te kunnen zien.,
binnenin het atoom
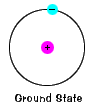 |
de aardtoestand van een elektron, het energieniveau dat het normaal inneemt, is de toestand van de laagste energie voor dat elektron. |
| er is ook een maximale energie die elk elektron kan hebben en nog steeds deel uitmaken van zijn atoom. Naast die energie is het elektron niet langer gebonden aan de kern van het atoom en wordt het geacht te zijn geïoniseerd., | 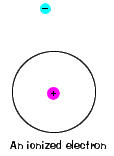 |
lichtenergie
de illustraties op deze pagina zijn natuurlijk vereenvoudigde versies van echte atomen. Echte atomen, zelfs relatief eenvoudige zoals Waterstof,hebben veel verschillende orbitalen, en dus zijn er veel mogelijke energiesmet verschillende begin-en eindtoestanden., Wanneer een atoom zich in een opgewekte toestand bevindt,kan het elektron in één keer helemaal naar de grondtoestand dalen, of onderweg stoppen op een gemiddeld niveau.
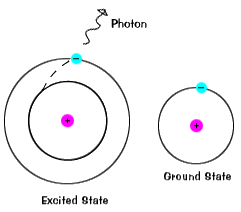 |
elektronen blijven niet lang in geëxciteerde toestanden – ze keren terug naar hun grondtoestanden en geven een foton uit met dezelfde energie als het geabsorbeerde foton., |
Identificatie van individuele atomen
transities tussen de verschillende orbitalen zijn uniek voor elk element omdat de energieniveaus uniek worden bepaald door de protonen en neutronen in de nucleus. We weten dat verschillende elementen verschillende aantallen protonen en neutronen in hun kernen hebben. Wanneer de elektronen van een bepaald atoom terugkeren naar lagere orbitalen uit opgewekte toestanden, hebben de fotonen die ze uitzenden energieën die kenmerkend zijn voor dat soort atomen., Dit geeft elk element een unieke vingerafdruk, waardoor het mogelijk is om de elementen te identificeren die aanwezig zijn in een container met gas, of zelfs een ster.
We kunnen hulpmiddelen zoals het periodiek systeem van elementen gebruiken om precies uit te zoeken hoeveel protonen, en dus elektronen, een atoom heeft. Allereerst weten we dat een atoom om een neutrale lading te hebben, hetzelfde aantal protonen en elektronen moet hebben. Als een atoom elektronen verliest of wint, wordt het geïoniseerd, of geladen. Het periodiek systeem geeft ons het atoomnummer van een element. Het atoomnummer geeft aan hoeveel protonen een atomhas heeft., Waterstof heeft bijvoorbeeld een atoomnummer van één – wat betekent dat het één proton heeft, en dus één elektron-en heeft eigenlijk geen neutronen.
voor de Student
op basis van de vorige beschrijving van het atoom, teken een model van het waterstofatoom. Het “standaard” model van een atoom is bekendals het Bohr-model.
verschillende vormen van hetzelfde chemische element die alleen verschillen door het aantal neutronen in hun kern worden isotopen genoemd. De meeste elementen hebben meer dan één natuurlijk voorkomende isotoop., Veel meer isotopen zijn geproduceerd in kernreactoren en wetenschappelijke laboratoria. Isotopen zijn meestal niet erg stabiel, en ze hebben de neiging om radioactief verval te ondergaan totdat iets stabieler wordt gevormd. U kent misschien het elementuranium-het heeft verschillende onstabiele isotopen, waarvan u-235 een van de meest bekende is. De 235 betekent dat deze vorm van uranium 235 neutronen en protonen gecombineerd heeft. Als we het atoomnummer van uranium opzochten, en dat substracteerden uit 235, konden we het aantal neutronen berekenen dat isotoop heeft.,
Hier is een ander voorbeeld – koolstof komt meestal voor in de vorm van C-12 (koolstof-12), dat wil zeggen, 6 protonen en 6 neutronen, hoewel één isotoop C-13 is, met 6proton en 7 neutronen.
voor de Student
gebruik het periodiek systeem en de namen van de elementen hieronder om erachter te komen hoeveel protonen, neutronen en elektronen ze hebben.Teken een model van een atoom van het volgende element: silicium-28, magnesium-24, zwavel-32, zuurstof-16 en helium-4.,
voor de Student
definieer met de tekst de volgende termen: energieniveaus, absorptie, emissie, aangeslagen toestand, aardtoestand, ionisatie, atoom,element, atoommassa, atoomnummer, isotoop.
een optionele opmerking over de kwantummechanische aard van atomenhoewel het hierboven beschreven Bohr-atoom een mooie manier is om de structuur van atomen te leren kennen, is het niet de meest accurate manier om ze te modelleren., hoewel elke orbitaal wel een precieze energie heeft, wordt de elektron nu voorgesteld als uitgesmeerd in een”elektronenwolk” die de kern omringt. Het is gebruikelijk om te spreken van de gemiddelde afstand tot thecloud als de straal van het elektron orbit.So vergeet niet dat we de woorden “orbitaal” en “orbitaal” houden, hoewel we ze nu gebruiken om niet een vlak orbitaal vlak te beschrijven, maar een regio waar een elektron een waarschijnlijkheid van zijn heeft. elektronen worden dicht bij de kern gehouden door de elektrische aantrekking tussen de kern en de elektronen.,Daar gehouden op dezelfde manier dat de negen planeten in de buurt van de zon blijven in plaats van het sterrenstelsel te roamen. In tegenstelling tot het zonnestelsel, waar de orbits van alle planeten zich op hetzelfde vlak bevinden, zijn elektronen meer driedimensionaal. Elk energieniveau op een atoom heeft een andere vorm. Er zijn wiskundeverschillen die je de waarschijnlijkheid vertellen van de locatie van het elektron in die baan. laten we eens kijken naar het waterstofatoom, waarvan we al een Bohr-model hebben getekend.,
de tekst en afbeeldingen in deze sectie zijn aangepast van Dave Slaven ‘ s pagina op het atoom (zie referenties hieronder). |
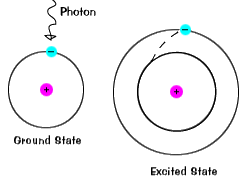 opgewonden state.An elektron kan opgewonden raken als het extra energie krijgt, zoals als het een foton absorbeert, of Lichtpakket, of botst met een nabijgelegen atoom of deeltje.
opgewonden state.An elektron kan opgewonden raken als het extra energie krijgt, zoals als het een foton absorbeert, of Lichtpakket, of botst met een nabijgelegen atoom of deeltje. 
