nucleofiele substitutie van de hydroxylgroep
het chemische gedrag van alkylhalogeniden kan worden gebruikt als referentie bij het ontdekken van analoge substitutie-en eliminatiereacties van alcoholen. Het belangrijkste verschil, natuurlijk, is een verandering in het verlaten anion van halogenide naar hydroxide. Omdat zuurstof iets meer elektronegatief is dan chloor (3,5 vs.2,8 op de Paulingschaal), wordt verwacht dat de C-O binding polair is dan een C-Cl binding., Bovendien geeft een onafhankelijke maat van de elektrofiele kenmerken van koolstofatomen uit hun NMR chemische verschuivingen (zowel 13C als Alfa protonen) aan dat zuurstof-en chloorsubstituenten een soortgelijke elektron-terugtrekkende invloed uitoefenen wanneer ze gebonden zijn aan SP3 gehybridiseerde koolstofatomen. Ondanks deze veelbelovende Achtergrondgegevens ondergaan alcoholen niet dezelfde SN2-reacties die gewoonlijk worden waargenomen met alkylhalogeniden. De snelle SN2-reactie van 1-broombutaan met natriumcyanide, zoals hieronder weergegeven, heeft bijvoorbeeld geen parallel wanneer 1-butanol wordt behandeld met natriumcyanide., In feite wordt ethylalcohol vaak gebruikt als oplosmiddel voor alkylhalide substitutiereacties zoals deze.
CH3CH2CH2CH2–Br + Na(+) GN(–)  CH3CH2CH2CH2–CN + Na(+) Br(–)
CH3CH2CH2CH2–CN + Na(+) Br(–)
CH3CH2CH2CH2–OH + Na(+) GN(–)  Geen Reactie
Geen Reactie
De belangrijkste factor hier is de stabiliteit van het verlaten van het anion (bromide vs. hydroxide)., HBr is een veel sterker zuur dan water (met meer dan 18 ordes van grootte), en dit verschil wordt weerspiegeld in reacties die hun respectievelijke geconjugeerde basen genereren. De zwakkere base, bromide, is stabieler en het vrijkomen ervan in een substitutie-of eliminatiereactie is veel gunstiger dan dat van hydroxide-ion, een sterkere en minder stabiele base.
een duidelijke stap in de richting van verbetering van de reactiviteit van alcoholen in SN2 –reacties zou zijn om de functionele groep-OH zodanig te wijzigen dat de stabiliteit ervan als verlaat anion wordt verbeterd., Een van deze modificaties is het uitvoeren van de substitutiereactie in een sterk zuur, het omzetten van –OH naar –OH2(+). Omdat het hydronium-ion (H3O (+)) een veel sterker zuur is dan water, is de geconjugeerde base (H2o) een betere vertrekgroep dan hydroxide-ion. Het enige probleem met deze strategie is dat veel nucleofielen, waaronder cyanide, gedeactiveerd worden door protonatie in sterke zuren, waardoor de nucleofiele co-reactant die nodig is voor de substitutie effectief wordt verwijderd., De sterke zuren HCl, HBr en HI zijn niet onderworpen aan deze moeilijkheid omdat hun geconjugeerde basen goede nucleofielen zijn en nog zwakkere basen zijn dan alcoholen. De volgende vergelijkingen illustreren enkele substitutiereacties van alcoholen die door deze zuren kunnen worden beïnvloed. Net als bij alkylhalogeniden verloopt de nucleofiele substitutie van 1º-alcoholen via een SN2-mechanisme, terwijl 3º-alcoholen reageren via een SN1-mechanisme. Reacties van 2º-alcoholen kunnen optreden door beide mechanismen en produceren vaak een aantal herschikte producten., De getallen tussen haakjes naast de mineraalzuurformules geven het gewichtspercentage van een geconcentreerde waterige oplossing weer, de vorm waarin deze zuren gewoonlijk worden gebruikt.
hoewel deze reacties soms “zuur-gekatalyseerd” worden genoemd, is dit niet strikt correct. Bij de totale omzetting wordt een sterk HX-zuur omgezet in water, een zeer zwak zuur, zodat ten minste een stoichiometrische hoeveelheid HX nodig is voor een volledige omzetting van alcohol in alkylhalide., De noodzaak om in deze reactie equivalente hoeveelheden zeer sterke zuren te gebruiken beperkt zijn nut tot enkelvoudige alcoholen van het hierboven beschreven type. Alcoholen met zuurgevoelige groepen verdragen een dergelijke behandeling natuurlijk niet. Niettemin kan het idee om de-OH functionele groep te wijzigen om zijn stabiliteit als een leaving anion te verbeteren in andere richtingen worden nagestreefd. Het volgende diagram toont enkele wijzigingen die effectief zijn gebleken. In elk geval wordt de hydroxylgroep omgezet in een ester van een sterk zuur. De eerste twee voorbeelden tonen de eerder beschreven sulfonaatesters., De derde en vierde voorbeelden tonen de vorming van een fosfietester (X staat voor de resterende broom of andere alcoholsubstituenten) en een chlorosulfietester, respectievelijk. Al deze verlaten groepen (gekleurd blauw) hebben geconjugeerde zuren die veel sterker zijn dan water (met 13 tot 16 bevoegdheden van tien); dus, het verlaten anion is overeenkomstig stabieler dan het hydroxide-ion. De mesylate en tosylate samenstellingen zijn bijzonder nuttig omdat zij in substitutiereacties met een grote verscheidenheid van nucleofielen kunnen worden gebruikt., De tussenproducten die worden geproduceerd in reacties van alcoholen met fosfortribromide en thionylchloride (laatste twee voorbeelden) worden zelden geïsoleerd en deze reacties blijven alkylbromide-en chlorideproducten produceren.
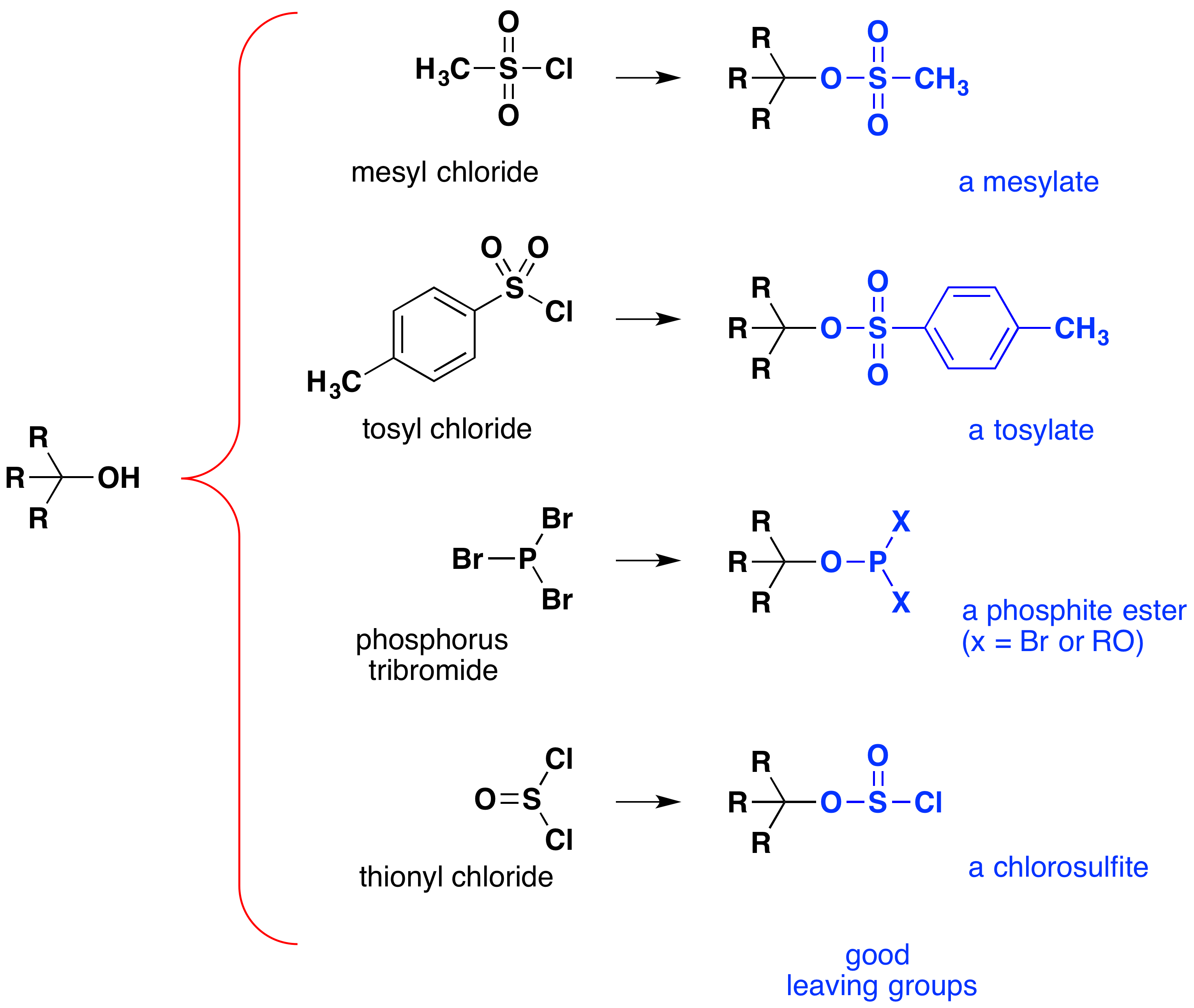
het belang van tussenproducten van sulfonaatester in algemene nucleofiele substitutiereacties van alcoholen kan worden geïllustreerd door de volgende omzetting van 1-butanol in pentaannitril (butylcyanide), een reactie die niet optreedt met de alcohol alleen., De fosfor-en thionylhalogeniden daarentegen werken alleen om alcoholen om te zetten in de overeenkomstige alkylhalogeniden.,
| CH3CH2CH2CH2–OH + CH3SO2Cl | pyridine
|
CH3CH2CH2CH2–OSO2CH3 | Na(+) CN(–)
|
CH3CH2CH2CH2–CN + CH3SO2O(–) Na(+) |
Some examples of alcohol substitution reactions using this approach to activating the hydroxyl group are shown in the following diagram., De eerste twee gevallen versterken het feit dat sulfonaatester-derivaten van alcoholen alkylhalogeniden in verschillende SN2-reacties kunnen vervangen. De volgende twee gevallen tonen het gebruik van fosfor tribromide aan bij de omzetting van alcoholen in bromiden. Dit reagens mag worden gebruikt zonder toegevoegde base (bv. pyridine) omdat het fosforzuurproduct een zwakker zuur is dan HBr. Fosfor tribromide wordt het best gebruikt met 1º-alcoholen omdat 2º-alcoholen vaak herschikkingsbijproducten opleveren als gevolg van concurrerende SN1-reacties., Merk op dat de etherzuurstof in reactie 4 niet door dit reagens wordt beïnvloed, terwijl de alternatieve synthese met geconcentreerde HBr ethers splijt. Fosfortrichloride (PCl3) zet op soortgelijke wijze alcoholen om in alkylchloriden, maar thionylchloride heeft meestal de voorkeur voor deze omzetting omdat de anorganische producten gassen zijn (SO2 & HCl). Fosfortrijodide is niet stabiel, maar kan in situ worden gegenereerd uit een mengsel van rode fosfor en jodium en werkt om alcoholen om te zetten in alkyljodiden., Het laatste voorbeeld toont de reactie van thionylchloride met een chirale 2º-alcohol. De aanwezigheid van een organische basis zoals pyridine is belangrijk omdat het een aanzienlijke concentratie van chloride-ion verstrekt die voor de definitieve SN2-reactie van het chlorosufite-tussenproduct wordt vereist., Bij afwezigheid van een base ontleden chloorsufieten bij verhitting tot het verwachte alkylchloride met behoud van configuratie
tertiaire alcoholen worden niet vaak gebruikt voor substitutiereacties van het hier besproken type, omdat SN1-en E1-reactiewegen dominant zijn en moeilijk te controleren zijn.

het belang van sulfonaatesters als tussenproducten in veel substitutiereacties kan niet worden overschat., Een rigoureus bewijs van de configuratieinversie die optreedt op de substitutieplaats in SN2 reacties maakt gebruik van dergelijke reacties. Een voorbeeld van een dergelijk bewijs wordt hieronder weergegeven. De volgende tabel bevat afkortingen voor de meest gebruikte sulfonylderivaten.
| Sulfonyl Groep | CH3SO2– | CH3C6H4SO2– | BrC6H4SO2– | CF3SO2– |
|---|---|---|---|---|
| Naam & Afkortingen., | Mesyl of Ms | Tosyl of Ts | Brosyl of Bs | Trifyl of Tf |
Inversie Bewijs

Voor een meer volledige bespreking van hydroxyl substitutie reacties en een beschrijving van de andere selectieve methoden voor deze omzetting, Klik Hier.
bijdragers
- William Reussch, emeritus hoogleraar (Michigan State U.,), Virtual Textbook of Organic Chemistry