een korte samenvatting van het Haber-proces
het Haber-proces combineert stikstof uit de lucht met waterstof afkomstig van voornamelijk aardgas (methaan) tot ammoniak. De reactie is reversibel en de productie van ammoniak is exotherm.,
![]()
![]()
een stroomschema voor het Haber-proces ziet er als volgt uit:
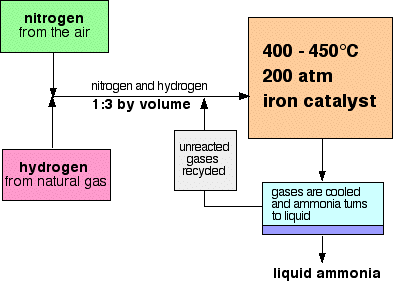
enkele opmerkingen over de Voorwaarden
De katalysator
de katalysator is eigenlijk iets ingewikkelder dan zuiver ijzer. Het heeft kaliumhydroxide toegevoegd aan het als promotor – een stof die de efficiëntie verhoogt.
de druk
de druk varieert van de ene fabriek tot de andere, maar is altijd hoog. Je kunt niet ver fout gaan in een examen met 200 atmosferen.,
Recycling
bij elke gasdoorlaat door de reactor wordt slechts ongeveer 15% van de stikstof en waterstof omgezet in ammoniak. (Dit cijfer varieert ook van plant tot plant.) Door continue recycling van de niet-gereageerde stikstof en waterstof bedraagt de totale conversie ongeveer 98%.
verklaart de omstandigheden
de verhoudingen stikstof en waterstof
het mengsel van stikstof en waterstof dat de reactor ingaat, is in de verhouding van 1 volume stikstof tot 3 volumes waterstof.,de wet van Avogadro zegt dat gelijke volumes gassen bij dezelfde temperatuur en druk gelijke aantallen moleculen bevatten. Dat betekent dat de gassen in de reactor gaan in de verhouding van 1 molecuul stikstof tot 3 waterstof.
dat is de verhouding die door de vergelijking wordt gevraagd.
in sommige reacties kunt u ervoor kiezen om een overmaat van een van de reactanten te gebruiken. U zou dit doen als het bijzonder belangrijk is om zoveel mogelijk van de andere reactant op te gebruiken – als het bijvoorbeeld veel duurder was. Dat geldt niet in dit geval.,
Er is altijd een keerzijde aan het gebruik van iets anders dan de verhouding van de vergelijking. Als je een overmaat van één reactant hebt zullen er moleculen door de reactor gaan die onmogelijk kunnen reageren omdat er niets voor hen is om mee te reageren. Hierdoor wordt reactorruimte verspild, met name ruimte op het oppervlak van de katalysator.
De temperatuur
Evenwichtsoverwegingen
u moet de positie van het evenwicht zoveel mogelijk naar rechts verschuiven om de maximaal mogelijke hoeveelheid ammoniak in het evenwichtsmengsel te produceren.,
De voorwaartse reactie (de productie van ammoniak) is exotherm.
![]()
![]()
volgens het principe van Le Chatelier zal dit worden bevorderd als u de temperatuur verlaagt. Het systeem zal reageren door de evenwichtspositie te verplaatsen om dit tegen te gaan – met andere woorden door meer warmte te produceren.
om zoveel mogelijk ammoniak in het evenwichtsmengsel te krijgen, heeft u een zo laag mogelijke temperatuur nodig. 400 – 450°C is echter geen lage temperatuur!,
Rate considerations
hoe lager de temperatuur die u gebruikt, hoe langzamer de reactie wordt. Een fabrikant probeert zoveel mogelijk ammoniak per dag te produceren. Het heeft geen zin om te proberen een evenwichtsmengsel te bereiken dat een zeer hoog gehalte aan ammoniak bevat als het enkele jaren duurt voordat de reactie dat evenwicht bereikt.
u hebt de gassen nodig om een evenwicht te bereiken binnen de zeer korte tijd dat ze in contact komen met de katalysator in de reactor.,
het compromis
400-450°C is een compromistemperatuur die een redelijk hoog gehalte aan ammoniak in het evenwichtsmengsel produceert (ook al is het slechts 15%), maar in een zeer korte tijd.
De druk
Evenwichtsoverwegingen
![]()
![]()
merk op dat er 4 moleculen aan de linkerkant van de vergelijking staan, maar slechts 2 aan de rechterkant.,
volgens het principe van Le Chatelier zal het systeem reageren door de reactie te bevorderen die minder moleculen produceert. Dat zal de druk weer doen dalen.
om zoveel mogelijk ammoniak in het evenwichtsmengsel te krijgen, heeft u een zo hoog mogelijke druk nodig. 200 atmosferen is een hoge druk, maar niet verbazingwekkend hoog.
Rate considerations
verhoging van de druk brengt de moleculen dichter bij elkaar., In dit specifieke geval, zal het hun kansen verhogen om te raken en te plakken aan het oppervlak van de katalysator waar ze kunnen reageren. Hoe hoger de druk hoe beter in termen van de snelheid van een gasreactie.
economische overwegingen
zeer hoge druk is om twee redenen zeer duur om te produceren.
u moet extreem sterke leidingen en insluitingsvaten bouwen om de zeer hoge druk te kunnen weerstaan. Dat verhoogt uw kapitaalkosten wanneer de fabriek wordt gebouwd.
hoge druk kost veel om te produceren en te onderhouden., Dat betekent dat de bedrijfskosten van uw installatie zeer hoog zijn.
het compromis
200 atmosferen is een compromisdruk gekozen om economische redenen. Als de druk die wordt gebruikt te hoog is, de kosten van het genereren van het hoger is dan de prijs die u kunt krijgen voor de extra ammoniak geproduceerd.
De katalysator
Evenwichtsoverwegingen
De katalysator heeft geen enkel effect op de positie van het evenwicht. Het toevoegen van een katalysator produceert geen groter percentage ammoniak in het evenwichtsmengsel. Zijn enige functie is om de reactie te versnellen.,
Rate considerations
bij afwezigheid van een katalysator is de reactie zo traag dat er vrijwel geen reactie plaatsvindt op een redelijk tijdstip. De katalysator zorgt ervoor dat de reactie snel genoeg is om een dynamisch evenwicht tot stand te brengen binnen de zeer korte tijd dat de gassen zich daadwerkelijk in de reactor bevinden.
scheiden van de ammoniak
wanneer de gassen de reactor verlaten zijn ze heet en onder een zeer hoge druk., Ammoniak wordt gemakkelijk vloeibaar gemaakt onder druk, zolang het niet te heet is, en zo wordt de temperatuur van het mengsel verlaagd genoeg om de ammoniak te veranderen in een vloeistof. De stikstof en waterstof blijven zelfs onder deze hoge druk als gassen achter en kunnen worden gerecycled.
vragen om uw begrip te testen
als dit de eerste reeks vragen is die u hebt gedaan, lees dan de inleidende pagina voordat u begint. U moet de knop terug in uw browser gebruiken om hier achteraf terug te komen.,
vragen over het Haber-proces
antwoorden
Waar wilt u nu naartoe?
naar het menu evenwicht . . .
naar het menu Fysische Chemie . . .
naar Hoofdmenu . . .