Inleiding
tijdens de winter krijgen dermatologen soms asymptomatische patiënten, met geen specifieke laesies anders dan, misschien, enige post-inflammatoire verkleuring, maar met een wanhopige behoefte aan hulp. Ze beginnen het verhaal te vertellen van een aantal papels of blaasjes die op hun huid verschijnen na de eerste intense blootstelling aan de zon van het jaar., Samen met de laesies begint en neemt een vreselijke jeuk toe met de verspreiding van de ziekte, na de volgende blootstelling aan de zon, soms verergerd door een soort branderig gevoel. Toch zijn deze mensen model zon zoekers en blijven genieten van de zon gedurende de zomer, wachtend tot de papels geleidelijk vervagen en verdwijnen. De belangrijkste vragen zijn: hoe kan ik dit voorkomen? Waarom krijg ik dit probleem sinds “5” jaar nu, maar ik heb het nooit eerder gehad?,
we hebben hoogstwaarschijnlijk te maken met polymorfe lichte eruptie (ple) en, op verzoek van onze patiënten, is medisch onderzoek voornamelijk gericht geweest op preventiestrategieën die tegenwoordig zeer bevredigend zijn geworden. Aan de andere kant blijft de tweede en zeker minder verkende vraag onduidelijk, tenzij er meerdere stukken zijn toegevoegd aan deze nogal gecompliceerde puzzel. Doel van dit korte overzicht is de meest recente vooruitgang op het gebied van de mogelijke mechanismen en de meest gebruikte protocollen voor preventie of behandeling te hervatten.
Pathophisiology of Polymorphic Light Eruption: Wat is er nieuw?,
PLE is de meest voorkomende lichtgevoelige aandoening, gekenmerkt door een intermitterende eruptie van niet-littekenhoudende erythemateuze papels, blaasjes of plaques (figuur 1) die zich ontwikkelen binnen uren na blootstelling aan ultraviolette straling (UVR) van de huid van de patiënt. De ziekte is afhankelijk van genetische gevoeligheid, evenals milieucomponent, zoals type blootstelling. PLE lijkt te cluster in families: er is geschat dat de prevalentie van PLE was 21 en 18% in monozygotische en dizygotische tweelingen, respectievelijk (1)., Bovendien was een positieve familiegeschiedenis van PLE bij eerstegraads familieleden aanwezig bij 12% van de getroffen tweelingparen, tegenover 4% van de onaangetaste tweelingparen (p < 0,0001). De probandwise concordantie in monozygotic was superieur dan in dizygotic tweelingparen (respectievelijk 0,72 vs. 0,30), waaruit een sterk genetisch effect blijkt (1). Vele genen van potentieel belang in de pathogenese van PLE zijn onderzocht met over het algemeen niet-tredende resultaten., Op basis van segregatieanalyse is geschat dat 72% van de Britse bevolking een allel met een lage penetrantie PLE gevoeligheid heeft (2).
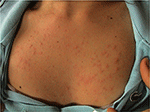
figuur 1. Klinisch beeld van polymorfe lichte uitbarsting bij een jonge vrouw.
het falen van apoptose: de mogelijke foto-geïnduceerde Neo-antigenen
in een recente genoombrede expressieanalyse werden slechts 16 genen na UV-bestraling verschillend uitgedrukt tussen PLE en gezonde controlegroepen (3)., Van deze genen, vertoonden 14 lagere uitdrukking in PLE patiënten, terwijl twee resulteerden over-uitgedrukt. Onder de 14 genen met lagere expressie in PLE zijn: complement 1s subeenheid (C1s), scavenger receptor B1 (SCARB1) fibronectine (FN1), immunoglobuline superfamilielid 3 (IGSF3), caspase-1 (CASP1) en paraoxonase 2 (PON2), alle genen geassocieerd met apoptotische celklaring. Er werd verondersteld dat eiwitmodificatie tijdens apoptotische celklaring zou kunnen leiden tot potentiële auto-antigeen vorming (4)., Dan, kan de verminderde uitdrukking in PLE patiënten van genen verbonden aan dit proces een mogelijke auto-antigeenbron, evenals een cruciale fase in de initiatie van het auto-immune proces vertegenwoordigen dat de ziekte bevordert (3). In overeenstemming met deze bevindingen, Kuhn et al. er werd accumulatie van apoptotische cellen waargenomen bij PLE-patiënten die werden bestraald met 1,5 minimale Erythema dosis (MED) UVB of 60-100 J/cm2 UVA1, vergeleken met de controlegroep (5).,
immuniteit: het falen van de tolerantie
Auto-antigenen als gevolg van de inefficiënte klaring van apoptotische cellen, worden waarschijnlijk opgenomen door dendritische cellen (DCs) en gepresenteerd aan naïeve T-cellen (cytotoxisch en helper) die vervolgens worden omgezet in auto-reactieve t-Cellen (6, 7). Dit gedeeltelijk falen van de apoptose draagt samen met de ontoereikende immunosuppressie na UV-blootstelling bij tot de herkenning en presentatie van antigeen, wat leidt tot de klinische manifestatie die kenmerkend is voor PLE-patiënten (8)., Inderdaad, het falen van normale UVR-geïnduceerde immunosuppressie is bewezen als de belangrijkste immunologische afwijking in PLE, aanvankelijk verklaard door de permanentie van Langerhanscellen (LCs) in de epidermis. Deze overactivering van het immuunsysteem, die ontsnapt aan de functionele UV-geïnduceerde tolerantie, is waarschijnlijk verantwoordelijk voor de verminderde prevalentie van huidkanker bij PLE-patiënten (9). Aan de andere kant is hetzelfde mechanisme schuldig aan het falen van de onderdrukking van allergische contactdermatitis (ACD), na UVR-blootstelling (10).,
inflammatoire route: vertraagde overgevoeligheidsreactie
de immunologische mechanismen die betrokken zijn bij PLE, met mediatoren van het aangeboren en adaptieve immuunsysteem, lijken zowel histologisch als biochemisch sterk op die van ACD. In feite gaf Epstein in de vroege jaren zeventig voor het eerst PLE aan als een vertraagde overgevoeligheidsreactie (dthr) op ongedefinieerd UVR-geïnduceerd huidantigeen (11). Onlangs, om dit concept te versterken, zijn sommige ontstekingsbemiddelaars betrokken bij ACD ook in PLE aangetoond., Bijvoorbeeld, IL – 1 familie (12, 13), een groeiende groep cytokines die verschillende rollen in immuunregulatie en ontsteking Spelen (14), ook betrokken bij ACD pathogenese (12, 15), is ook onderzocht in PLE (16). IL-36α en IL-36γ, de pro-inflammatoire leden van de IL-1 familie waren verhoogd in PLE met betrekking tot controles, zoals voor ACD monsters, maar IL-36γ was veel verbeterd in PLE dan in ACD (16). De werking via de gemeenschappelijke receptor die bestaat uit IL-36R en IL-1R/AcP (IL-1RL2), IL-36α, IL-36β en IL-36γ activeert NF-kB en MAPKs en bevordert ontstekingsreacties., De toename van IL-36s in de huid en het perifere bloed van PLE-patiënten wijst op de activering van de lokale en systemische immuunrespons, zoals waargenomen bij meerdere inflammatoire huidaandoeningen (15, 17, 18). Waarschijnlijk wordt de link tussen IL-36s en UVR blootstelling vertegenwoordigd door het paracrine pro-inflammatoire signaal van toll like receptor (TLR)-3 activering, als gevolg van de afgifte van RNA door necrotische keratinocyten (19). Inderdaad, het falen van apoptotische klaring in PLE, met een overvloed aan cellulair puin, kan verantwoordelijk zijn voor een versterking van dit “alarmsignaal.,”
bovendien zou IL-36s kunnen bijdragen tot de versterking van het aangeboren immuunsignaal en de daaruit voortvloeiende ontstekingscascade, waardoor antimicrobiële peptiden (AMPs) worden bevorderd (20).
inflammatoire route: ampère en microbioom
zoals grotendeels onderzocht in meervoudige huidontstekingsprocessen, zijn deze mediatoren, genaamd defensines (α En β), cathelicidin (LL37), ribonuclease 7 (RNase7) en psoriasin (s100a7), in het licht van de onbalans die door UVR op keratinocyten en huidmicrobioom wordt geïnduceerd, ook onderzocht in PLE (21, 22). Patra et al., hebben gevonden dat de expressie van psoriasin, RNase7, HBD-2, en LL-37 was verhoogd in PLE lesional huid, terwijl HBD-3 was verlaagd. Gezien het huidoppervlak als een “multi-etnische wereld”, zonder de cruciale rol van keratinocyten te vergeten, kunnen we niet uitsluiten dat de afgifte van versterkers kan worden bepaald door modificatie in microbioomcomponenten na UV-interactie (23). Inderdaad, kon microbiome de bron vertegenwoordigen, direct of indirect, van nog niet ontdekte UVR-veroorzaakte die antigenen in PLE-patiënten worden gevormd, die tot keratinocyteschade leiden., Als gevolg hiervan zou LL-37, ook geïnduceerd door UVB, IFNy, TNF-α, IL-6, een potentiële indirecte aanjager van PLE kunnen zijn (23). Het kan aggregaten vormen met zelfnucleic zuren die PDC ‘ s kunnen activeren: bij psoriasis is het erkend als de belangrijkste autoantigen (24). Hoewel bij PLE-patiënten een volledige afwezigheid van PDC ‘ s is gemeld (25), bestaat er een auto-immuun milieu, en LL-37 zou een centrale rol kunnen spelen, die andere inflammatoire wegen induceert. In Figuur S1 (aanvullend materiaal) worden de bovenstaande concepten gevisualiseerd in een cartoon.
therapie van polymorfe Lichteruptie: Wat is er nieuw?,
de eerste regel van de behandeling voor PLE omvat het vermijden van de zon, zonnebrandmiddelen en topische corticosteroïden (26). Voor alle patiënten is preventieve behandeling van fundamenteel belang tijdens zonnig weer, door het vermijden van intense UVR-blootstelling en het gebruik van beschermende kleding, evenals het aanbrengen van zonnebrandcrème, met name tijdens de eerste blootstelling van het jaar. Van nieuwe generatie breedspectrumzonwering, met een hoge zonbeschermingsfactor voor UVB (SPF), in combinatie met een langere golflengte-UVA-bescherming, is gemeld dat ze volledige of gedeeltelijke bescherming bieden bij tot 90% van de PLE-patiënten (27, 28)., Het gebruik van orale antioxidanten en nicotinamide kan een extra geldige preventieve maatregel voor deze patiënten zijn. De gunstige effecten van nicotinamide zijn onderzocht in een ongecontroleerd onderzoek bij 42 patiënten, waarbij 60% van hen volledige afschaffing van de symptomen meldde bij het nemen van 2-3 g nicotinamide per dag, vóór blootstelling aan de zon (29). Bovendien is aangetoond dat een extract van de tropische varenpolypodiumleucotomos [PL) zowel krachtige antioxidanten als immunomodulerende effecten heeft., Wanneer 480 mg/dag voor blootstelling aan de zon werd toegediend, verminderde het de huidreacties en subjectieve symptomen significant (30, 31). Met betrekking tot topische corticosteroïden, zelfs als er geen proeven zijn gedaan om hun doeltreffendheid in PLE te bepalen, worden zij wijd gebruikt om jeuk te verminderen (26). De tweede lijn van behandelingen voor PLE omvat systemische corticosteroïden en foto (chemo)therapie (26). In een gerandomiseerd, dubbelblind, placebogecontroleerd onderzoek (32) suggereerden de auteurs het gebruik van 25 mg prednisolon dagelijks gedurende 4-5 dagen bij het begin van de uitbarsting., Hoewel de mogelijke bijwerkingen op lange termijn van herhaalde kuren met prednisolon moeten worden overwogen, kan het worden geadviseerd voor patiënten die lijden aan occasionele aanvallen van PLE, in afwezigheid van contra-indicaties. In mildere gevallen van PLE kan een zelfconditioneringsprogramma door een afgestudeerde blootstelling aan zonlicht in het voorjaar voldoende zijn (33). Terwijl, in ernstigere gevallen, behandeling onder medisch toezicht conditionering/desensibilisatie geschikter kan zijn., Een cursus psoralen en Uva therapie (PUVA), smalband (NB)-UVB of breedband (BB)-UVB fototherapie, meestal toegediend in het vroege voorjaar, kan effectief zijn, evenals profylactische behandeling (26). Het behandelingsprotocol bestaat over het algemeen uit één cursus fototherapie/fotochemotherapie gedurende 5-6 weken. Startdoses zijn afhankelijk van minimale erythemale dosis (MED) of minimale fototoxische dosis (MPD) en zijn vaak 50-70% van deze gemeten drempels met incrementele verhogingen., Om het voordeel verkregen met de desensibiliserende therapie te behouden, wordt een regelmatige blootstelling aan de zon gedurende de zomer geadviseerd, anders kan de verharding binnen 4-6 weken verloren gaan. Bij de behandeling van PLE verdient NB-UVB de voorkeur boven PUVA (sterkte van aanbeveling D; mate van bewijs 4), vanwege het lagere risico op fotocarcinogenese, geen risico op misselijkheid of andere bijwerkingen geassocieerd met de inname van MOP en geen noodzaak om na de behandeling oogbescherming te gebruiken. Echter, PUVA dient te worden overwogen, voordat andere systemische behandelingen plaatsvinden, als NB-UVB niet is aangeslagen of eerder de uitbarsting heeft veroorzaakt., Zoals hieronder beschreven, is de werkzaamheid aangetoond voor meerdere fototherapieregimes (BB-UVB, NB-UVB en PUVA), en bijwerkingen, in termen van provocatie van huiduitslag, erytheem en jeuk bleken vaker voor te komen bij UVB dan bij PUVA (34). Zoals samengevat in de literatuur resulteert de werkzaamheid van PUVA in een fotoprotectiepercentage van 65-100% (34)., Er zijn meerdere vergelijkende onderzoeken uitgevoerd, maar uit het enige gerandomiseerde gecontroleerde onderzoek tussen PUVA en NB-UVB plus placebotabletten, driemaal per week, gedurende 5 weken, kwam geen significant verschil in werkzaamheid naar voren, rekening houdend met het optreden van PLE of beperking van de activiteit buitenshuis (35). In the 10 years retrospective review, gerapporteerd door Man et al. (36) kregen 170 patiënten met matige tot ernstige PLE PUVA-en/of UVB-fototherapie. In detail kregen 8 patiënten PUVA, 128 NB-UVB, 5 BB-UVB en 29 patiënten, die niet voldoende reageerden op NB-UVB, PUVA het volgende jaar., Er werden zelfevaluaties gemaakt van de ernst en de frequentie van PLE-episoden werden gemeld tijdens de follow-upbezoeken in de herfst of tijdens het volgende voorjaar. Een goede of matige verbetering werd gemeld bij 88% van de met PUVA behandelde patiënten en bij 89% van de patiënten die UVB kregen. Van de patiënten behandeld met zowel PUVA als NB-UVB gaf de meerderheid de voorkeur aan PUVA. In een andere 14-jarige retrospectieve studie met 79 patiënten behandeld met fototherapie (37) was de werkzaamheid, gemeten tijdens de volgende zomer in termijn van fotoprotectie met volledige/partiële remissie, 65% voor PUVA, 82% voor BB-UVB en 83% voor UVA alleen., In dit geval was de behandeling met PUVA voorbehouden aan ernstigere PLE-vormen.
de mechanismen waarmee fototherapie fotoprotectie induceert zijn niet volledig begrepen.
De laatste jaren zijn echter veel vorderingen gemaakt. Naast de bekende effecten op melaninisatie en epidermale verdikking van fototherapie, wordt een breed scala aan UV-geïnduceerde immunomodulerende en ontstekingsremmende eigenschappen gerapporteerd (38)., Zowel UVB als UVA moduleren de expressie van het adhesiemolecuul en induceren oplosbare mediatoren, zoals A-melanocyt-stimulerend hormoon, IL-10 (dat de productie van interferon-γ onderdrukt) en prostaglandine E2, die ontstekingsremmende acties expliciteren, de activering van T-cellen voorkomen en apoptose van huidinfiltrerende T-cellen bevorderen (34). Bovendien is aangetoond dat profylactische UV-fotoharding bij PLE-patiënten de UV-geïnduceerde LC-migratie van de epidermis naar de huid drainerende lymfeklieren herstelt: een van de belangrijkste cellulaire gebeurtenissen bij UV-immunosuppressie (39)., De door LC geïnduceerde tolerantie wordt gemedieerd door de afgifte van immunosuppressieve cytokine zoals IL-10, en door de interferentie met rijping en inductie van regulerende T-cellen (Tregs) (40). Bovendien is onlangs een interessant verband gemeld tussen LC, Tregs en vitamine D3. Er is inderdaad aangetoond dat een kortdurende topische voorbehandeling van 1 week met het 1,25-dihydroxyvitamine d-analoog, calcipotriol, de PLE-symptomen na daaropvolgende experimentele fotoprovocatie verminderde (41)., Bovendien vertoonde 1,25-dihydroxyvitamine D in een muriene studie vergelijkbare immunosuppressieve effecten als UV (42). Een andere interessante kruisverwijzing is gemarkeerd tussen LCs en mastcellen. Naast hun erkende rol in atopie, zijn huidmastcellen ook verantwoordelijk voor het beschermen van de huid tegen UVB-geïnduceerde ontsteking, het bevorderen van UV-immunosuppressie (40). Onderzoek bij de mens heeft aangetoond dat na acute en chronische UVR-blootstelling het aantal huidmastcellen toeneemt, samen met de afgifte van IL-10., Over het algemeen suggereren deze gegevens een potentiële rol voor mestcellen in PLE, en in het mechanisme van photohardening. In overeenstemming met deze, Wolf et al. hebben voor het eerst gemeld dat fotoharding de dichtheid van mestcellen in de papillaire dermis van PLE-patiënten significant verhoogt (40). Samenvattend, photohardening werkt in PLE door het herstellen van de normale UV immune suppressieve weg, waarbij meerdere celtypes. De derde lijn behandeling voor PLE omvat het gebruik van systemische immunosuppressieve geneesmiddelen, zoals azathioprine en cyclosporine., Echter, slechts sporadische gevallen van met succes behandelde patiënten worden gemeld in de literatuur (43, 44). Bovendien zijn hydroxychloroquine, omega-3 vetzuren en beta-caroteen voorgesteld als behandelingen, maar verdere dubbelblinde, gerandomiseerde gecontroleerde proeven om hun klinische werkzaamheid echt te beoordelen zijn vereist.
conclusies
aangezien de hoge prevalentie en toenemende incidentie van PLE, geassocieerd met ongemak en beperkingen in de levensstijl, zijn toekomstige studies nodig om nieuwe therapeutische en / of preventieve strategieën te vinden., De keuze van de juiste PLE-behandeling vereist een goede kennis van het individuele klinische verloop van de ziekte en de mogelijkheid om fototest uit te voeren. Enkele nieuwe aspecten in de mogelijke activering en bevordering van het ontstekingsproces zijn benadrukt.,
bij de huidige stand van de kennis is het, ondanks de identificatie van een aantal cruciale cellulaire Regulatie die betrokken is bij het herstel van de immuuntolerantie, moeilijk om definitieve conclusies te trekken over de werkzaamheid van verschillende mogelijke behandelingen bij PLE, vanwege het ontbreken van adequate studies en de moeilijkheid om uitkomstmetingen te beoordelen. De klinische score voor de beoordeling van de ernst van PLE (PLESI) (45) blijft een instrument dat nauwelijks wordt gebruikt en voornamelijk beperkt is tot onderzoeksdoeleinden., De diepere studie van de onderliggende pathogenetische mechanismen van de aandoening zal een meer gerichte behandeling benadering mogelijk te maken.
Auteursbijdragen
SL projecteerde het manuscript, selecteerde het materiaal voor het papier, schreef het oorspronkelijke ontwerp en corrigeerde de volgende ontwerpen van het manuscript. AR was bezig met het schrijven van het manuscript, het ondersteunen van nieuwe ideeën van inhoud en stijl.,
belangenconflict verklaring
De auteurs verklaren dat het onderzoek werd uitgevoerd zonder enige commerciële of financiële relatie die als een potentieel belangenconflict kon worden opgevat.
aanvullend materiaal
figuur S1. Interactie tussen aangeboren en adaptief immuunsysteem in een context van apoptosis falen in de epidermis. (Groen symbool) Psoriasin: overvloedige expressie in doornachtige en korrelige lagen van PLE huid. (Blauw symbool) RNase7: voornamelijk uitgedrukt in keratinocyten van de stratum granulosum en stratum corneum van PLE laesies., (Geel symbool) LL-37 werd diep uitgedrukt in en rond bloedvaten en klieren in PLE. (Violet celsymbool) apoptotische keratinocyten met inefficiënte klaring.,hic light eruption; ACD, Allergic contact dermatitis; DTHR, Delayed type hypersensitivity reaction; UVR, Ultraviolet radiation; C1s, Complement 1s subunit; SCARB1, Scavenger receptor B1; FN1, Fibronectin; IGSF3, Immunoglobulin superfamily member 3; CASP1, Caspase-1; PON2, Paraoxonase 2; MED, Minimal Erythema Dose; DCs, Dendritic cells; LCs, Langerhans cells; TLR, Toll like receptor; AMPs, Antimicrobial peptides; SPF, Sun protection factor; PUVA, Psoralen and UVA therapy; NB-UVB, Narrowband; BB-UVB, Broadband UVB; MPD, Minimum phototoxic dose; Tregs, Regulatory T cells; PL, Polypodiumleucotomos.,
2. McGregor JM, Grabczynska S, Vaughan R, Hawk JL, Lewis CM. Genetic modelling of abnormal photosensitivity in families with polymorphic light eruption and actinic prurigo. J Invest Dermatol. (2000) 115:471–6. doi: 10.1046/j.1523-1747.2000.00080.x
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Lembo S, Hawk JLM, Murphy GM, Kaneko K, Young AR, McGregor JM, et al., Aberrant gene expression with deficient apoptotic keratinocyte clearance may predispose to polymorphic light eruption. Br J Dermatol. (2017) 177:1450–3. doi: 10.1111/bjd.15200
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Savill J, Fadok V. Corpse clearance defines the meaning of cell death. Nature (2000) 407:784–8. doi: 10.,1038/35037722
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Kuhn A, Herrmann M, Kleber S, Beckmann-Welle M, Fehsel K, Martin-Villalba A, et al. Accumulation of apoptotic cells in the epidermis of patients with cutaneous lupus erythematosus after ultraviolet irradiation. Arthritis Rheum. (2006) 54:939–50. doi: 10.1002/art.21658
PubMed Abstract | CrossRef Full Text | Google Scholar
6., Savill J, Dransfield I, Gregory C, Haslett C. A blast from the past: clearance of apoptotic cells regulates immune responses. Nat RevImmunol. (2002) 2:965–75. doi: 10.1038/nri957
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Albert ML, Sauter B, Bhardwaj N. Dendritic cells acquire antigen from apoptotic cells and induce class I-restricted CTLs. Nature (1998) 392:86–9. doi: 10.,1038/32183
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Koulu LM, Laihia JK, Peltoniemi HH, Jansén CT. UV-induced tolerance to a contact allergen is impaired in polymorphic light eruption. J Invest Dermatol. (2010) 130:2578–82. doi: 10.1038/jid.2010.181
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Epstein JH. Polymorphous light eruption. J Am Acad Dermatol. (1980) 3:329–43.,
PubMed Abstract | Google Scholar
12. Mattii M, Ayala F, Balato N, Filotico R, Lembo S, Schiattarella M, et al. The balance between pro- and anti-inflammatory cytokines is crucial in human allergic contact dermatitis pathogenesis: the role of IL-1 family members. Exp Dermatol. (2013) 22:813–9. doi: 10.1111/exd.12272
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Dinarello CA., Interleukine-1 in de pathogenese en behandeling van ontstekingsziekten. Blood (2011) 117:3720-32. doi: 10.1182 / bloed-2010-07-273417
PubMed Abstract / CrossRef Full Text / Google Scholar
16. Lembo S, Caiazzo G, Balato N, Monfrecola G, Patra V, Wolf P, et al. Polymorfe lichteruptie en IL – 1 familieleden: enig verschil met allergische contactdermatitis? Photochem Photobiol Sci. (2017) 16:1471–9. doi: 10.,1039/c7pp00142h
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Balato A, Schiattarella M, Lembo S, Mattii M, Prevete N, Balato N, et al. Interleukin-1 family members are enhanced in psoriasis and suppressed by vitamin D and retinoic acid. Arch Dermatol Res. (2013) 305:255–62. doi: 10.1007/s00403-013-1327-8
PubMed Abstract | CrossRef Full Text | Google Scholar
19., Borkowski AW, Kuo IH, Bernard JJ, Yoshida T, Williams MR, Hung NJ. De Toll-like receptor 3 activering is vereist voor normale reparatie van de huidbarrière na UV-schade. J. Invest Dermatol. (2015) 135:569–78. doi: 10.1038 / jid.2014.354
PubMed Abstract | CrossRef Full Text/Google Scholar
20. Li N, Yamasaki K, Saito R, Fukushi-Takahashi S, Shimada-Omori R, Asano M, et al. Alarminfunctie van cathelicidine antimicrobial peptide LL37 door il-36γ-inductie in menselijke epidermale keratinocytes. J Immunol., (2014) 193:5140–8. doi: 10.4049/jimmunol.1302574
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Patra V, Wolf P. Microbial elements as the initial triggers in the pathogenesis of polymorphic light eruption? Exp Dermatol. (2016) 25:999–1001. doi: 10.1111/exd.13162
PubMed Abstract | CrossRef Full Text | Google Scholar
22., Gläser R, Navid F, Schuller W, Jantschitsch C, Harder J, Schröder JM, et al. UV-B-straling induceert de expressie van antimicrobiële peptiden in menselijke keratinocyten in vitro en in vivo. J Allergie Clin Immunol. (2009) 123:1117–23. doi: 10.1016 / j. jaci.2009.01.043
PubMed Abstract | CrossRef Full Text/Google Scholar
23. Patra V, Mayer G, Gruber-Wackernagel A, Horn M, Lembo S, Wolf P., Uniek profiel van antimicrobiële peptide uitdrukking in polymorfe lichte eruptie laesies in vergelijking met gezonde huid, atopische dermatitis, en psoriasis. Photodermatol Photoimmunol Photoomed. (2018) 34:137–44. doi: 10.1111 / phpp.12355
PubMed Abstract | CrossRef Full Text/Google Scholar
25. Schweintzger NA, Gruber-Wackernagel A, Shirsath N, Quehenberger F, Obermayer-Pietsch B, Wolf P. Influence of the seasons on vitamin D levels and regulatory T cells in patients with polymorphic light eruption., Photochem Photobiol Sci. (2016) 15:440–6. doi: 10.1039/c5pp00398a
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Proby C, Baker C, Morton O, Hawk JLM. New broad spectrum sunscreen for polymorphic light eruption. Lancet (1993) 341:1347–8.
PubMed Abstract | Google Scholar
28. Allas S, Lui H, Moyal D, Bissonnette R., Vergelijking van het vermogen van 2 zonnebrandmiddelen om te beschermen tegen polymorfe lichtuitbarsting veroorzaakt door een UV-A/UV-B metaalhalogenidelamp. Arch Dermatol. (1999) 135:1421–2.
PubMed Abstract / Google Scholar
29. Ortel B, Wechdorn D, Tanew A, Honigsmann H. Effect of nicotinamide on the phototest reaction in polymorfe lighteruption. Br J Dermatol. (1988) 118:669–73.
PubMed Abstract / Google Scholar
30., Caccialanza M, Percivalle S, Piccinno R, Brambilla R. Photoprotective activity of oral Polypodiumleucotomos extract in 25 patients with idiopathic photodermatoses. Photodermatol Photoimmunol Photomed. (2007) 23:46–7. doi: 10.1111/j.1600-0781.2007.00274.x
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Tanew A, Radakovic S, Gonzalez S, Venturini M, Calzavara-Pinton P. Oral administration of a hydrophilic extract of Polypodiumleucotomos for the prevention of polymorphic light eruption., J Am Acad Dermatol. (2012) 66:58–62. doi: 10.1016/j.jaad.2010.09.773
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Van Praag MCG Boom, BW, Vermeer BJ. Diagnosis and treatment of polymorphous light eruption. Int J Dermatol. (1994) 33:233–9.
Google Scholar
34. Ling TC, Clayton TH, Crawley J, Exton LS, Goulden V, Ibbotson S, et al., British association of dermatologists and british photodermatology group guidelines for the safe and effective use of psoralen-ultraviolet a therapy 2015. Br J Dermatol. (2016) 174:24–55. doi: 10.1111 / bjd.14317
PubMed Abstract / CrossRef Full Text / Google Scholar
36. Man I, Dawe RS, Ferguson J. kunstmatige verharding voor polymorfe lichte eruptie: praktische punten uit tien jaar ervaring. Photodermatol Photoimmunol Photoomed. (1999) 15:3–4.,
PubMed Abstract | Google Scholar
37. Mastalier U, Kerl H, Wolf P. Clinical laboratory, phototest and phototherapy findings in polymorphic light eruptions: a retrospective study of 133 patients. Eur J Dermatol. (1998) 8:554–9.
PubMed Abstract | Google Scholar
38. Krutmann J, Morita A. Mechanisms of ultraviolet (UV) B and UVA phototherapy. J Invest Dermatol Symp Proc. (1999) 4:70–2.,
PubMed Abstract | Google Scholar
39. Janssens AS, Pavel S, Out-Luiting JJ, Willemze R, de Gruijl FR. Normalized ultraviolet (UV) induction of Langerhans cell depletion and neutrophil infiltrates after artificial UVB hardening of patients with polymorphic light eruption. Br J Dermatol. (2005) 152:1268–74. doi: 10.1111/j.1365-2133.2005.06690.x
PubMed Abstract | CrossRef Full Text | Google Scholar
40., Wolf P, Gruber-Wackernagel A, Bambach I, Schmidbauer U, Mayer G, Absenger M, et al. Photohardening van polymorfe lichteruptie patiënten vermindert de baseline epidermale celdichtheid van Langerhans terwijl het aantal mestcellen in de papillaire dermis toeneemt. Exp Dermatol. (2014) 23:428–30. doi: 10.1111/exd.12427
PubMed Abstract | CrossRef Full Text/Google Scholar
42. Schwarz A, Navid F, Sparwasser T, Clausen BE, Schwarz T., 1,25-dihydroxyvitamin D exerts similar immunosuppressive effects as UVR but is dispensable for local UVR-induced immunosuppression. J Invest Dermatol. (2012) 132, 2762–9. doi: 10.1038/jid.2012.238
PubMed Abstract | CrossRef Full Text | Google Scholar
43. Norris PG, Hawk JL. Successful treatment of severe polymorphous light eruption with azathioprine. Arch Dermatol. (1989) 125:1377–9.
PubMed Abstract | Google Scholar