staal is tegenwoordig het meest gebruikte materiaal. Staal heeft echter een groot nadeel-de hoge corrosiesnelheid. De bescherming van staalconstructies en-onderdelen is daarom van groot economisch belang.
de beste corrosiebescherming voor staal wordt verkregen met zink. Zinkbekledingen op staal beschermen op twee manieren tegen corrosie:
- door een barrière-effect, d.w.z. ze voorkomen dat zuurstof en vocht het staaloppervlak bereiken.,
- door kathodische bescherming bij krassen, spaanders, randen enz.
zink is een metaal met een relatief laag galvanisch potentieel en een hoge neiging tot corrosie. Echter, de corrosiesnelheid is laag in de meeste omgevingen, omdat het oppervlak van de coating snel wordt bedekt met corrosieproducten, die vervolgens beschermen tegen verdere corrosie.
corrosie in de atmosfeer
wanneer een thermisch verzinkt object het zinkbad verlaat, wordt het oppervlak van het object onmiddellijk aangevallen door zuurstof in de lucht., De resulterende oxidelaag heeft zeer weinig vermogen om tegen corrosie te beschermen. Water en kooldioxide in de lucht veranderen de oxidelaag echter snel in zinkcarbonaten. Deze geven een verzegelde laag met een zeer goede hechting. Aangezien de carbonaten zeer weinig oplosbaar zijn in water, bieden ze een uitstekende bescherming aan het oppervlak van de zinkcoating. Het oorspronkelijke glanzende oppervlak met een metallic glans verdwijnt om vervangen te worden door een matte, lichtgrijze kleur (fig.1).

Fig 1., Blootgestelde oppervlakte van een zinkcoating met buitenlaag van zuiver zink. Het glanzende oppervlak verdwijnt om te worden vervangen door grijze corrosieproducten (ook wel Zinkpatina genoemd).

Fig. 2. Verkleurd oppervlak op lichtkolom. Coating bestaat voornamelijk uit een ijzer-zinklegering die zich uitstrekt tot het oppervlak. Ijzer wordt blootgesteld tijdens corrosie, wat leidt tot roestvorming. Het is alleen oppervlakte roest en is alleen van esthetische betekenis.,
buitenlucht bevat meer of minder corrosieve elementen — gassen, roet, vochtigheid (mist, dauw, regen, sneeuw), inert en agressief stof. Niveaus kunnen variëren met de locatie en de tijd van het jaar. Sulfaten en sulfieten van zink zijn wateroplosbaar en hebben een slechte hechting aan het zinkoppervlak. Ze worden daarom gemakkelijk weggespoeld door regen. Een vers zinkoppervlak wordt dan blootgesteld aan aanval door zuurstof in de lucht en de corrosiecyclus wordt herhaald. De corrosie in zwaveloxiden bevattende lucht is dus groter dan in schone lucht., De hoeveelheid zwaveldioxide in de atmosfeer is de laatste jaren echter drastisch gedaald, waardoor ook de zinkcorrosie is afgenomen.
in mariene milieus wordt de corrosie van zink beïnvloed door het zoutgehalte van de lucht. Echter, marine air bevat kleine hoeveelheden magnesiumzouten, met goede passiverende invloeden. Corrosie is dus niet zo groot als verwacht mag worden. Het zoutgehalte van de lucht vermindert snel weg van de kust.
de corrosie van zink wordt door vele factoren beïnvloed., Dit betekent dat er geen algemeen toepasbare formule voor corrosiesnelheden kan worden gegeven. Zinkcoatings worden echter al lange tijd onder uiteenlopende omstandigheden gebruikt om staal tegen roest te beschermen. Er is ook een groot aantal tests op lange termijn uitgevoerd. Kennis over de corrosie van zink en corrosie tarieven in verschillende omgevingen is daarom goed. Tegenwoordig zijn er voorbeelden van zinkcoatings die al meer dan honderd jaar worden blootgesteld.
De kleur van corrosieproducten varieert afhankelijk van de omgeving waarin ze worden gevormd., Mariene omgevingen geven iets wittere corrosieproducten in vergelijking met landelijke en stedelijke omgevingen. Corrosieproducten zijn meestal het donkerst in stedelijke omgevingen.
corrosie in vloeistoffen
het zinkoppervlak is over het algemeen bedekt met een beschermende laag corrosieproducten wanneer het in een vloeistof wordt ondergedompeld. Vloeistoffen kunnen echter zuur of alkalisch zijn en kunnen opgeloste of vaste deeltjes van agressieve stoffen bevatten. De temperatuur en het debiet van de vloeistof zijn ook van belang., Dit alles betekent dat de beschermende laag een sterk variërende samenstelling kan hebben of helemaal niet kan vormen.
elektrochemische corrosie, die een ondergeschikte rol speelt in lucht, is van grotere betekenis in vloeistoffen. De mate van elektrochemische corrosie hangt af van de elektrische geleidbaarheid van de vloeistof, die de beschermende invloed van de zinklaag over Grotere of kleinere gebieden beïnvloedt.
de pH-waarde van de vloeistof is van het grootste belang. De corrosiesnelheid van zink is normaal laag en stabiel in het pH-bereik van 5,5-12,5, bij temperaturen tussen 0 en 20 °C., Corrosie buiten dit bereik is meestal sneller.
Hard water, dat kalk en magnesium bevat, is minder agressief dan zacht water. Samen met kooldioxide vormen deze stoffen spaarzaam oplosbare carbonaten op het zinkoppervlak, waardoor het zink wordt beschermd tegen verdere corrosie.
zacht water valt vaak zink aan, omdat de afwezigheid van zouten betekent dat de beschermende laag niet kan worden gevormd.
agressief zacht water komt voor in vele rivieren en meren in Finland, noorwegen, zweden en soortgelijke milieus.
als het debiet groter is dan 0.,5 m / s de vorming van de beschermende laag op het zinkoppervlak wordt geremd en corrosie versnelt.
watertemperatuur is van groot belang voor de corrosiesnelheid. Boven ongeveer 55 °C krijgen de laagvormende corrosieproducten een grofkorrelige structuur en verliezen ze de hechting aan het zinkoppervlak. Ze zijn gemakkelijk losgemaakt en bloot nieuw, vers zink voor voortdurende en snelle corrosieaanval. De corrosiesnelheid bereikt een maximum bij ongeveer 70 °C, waarna het afneemt zodat het bij 100 °C ongeveer hetzelfde is als bij 50 ° C.,
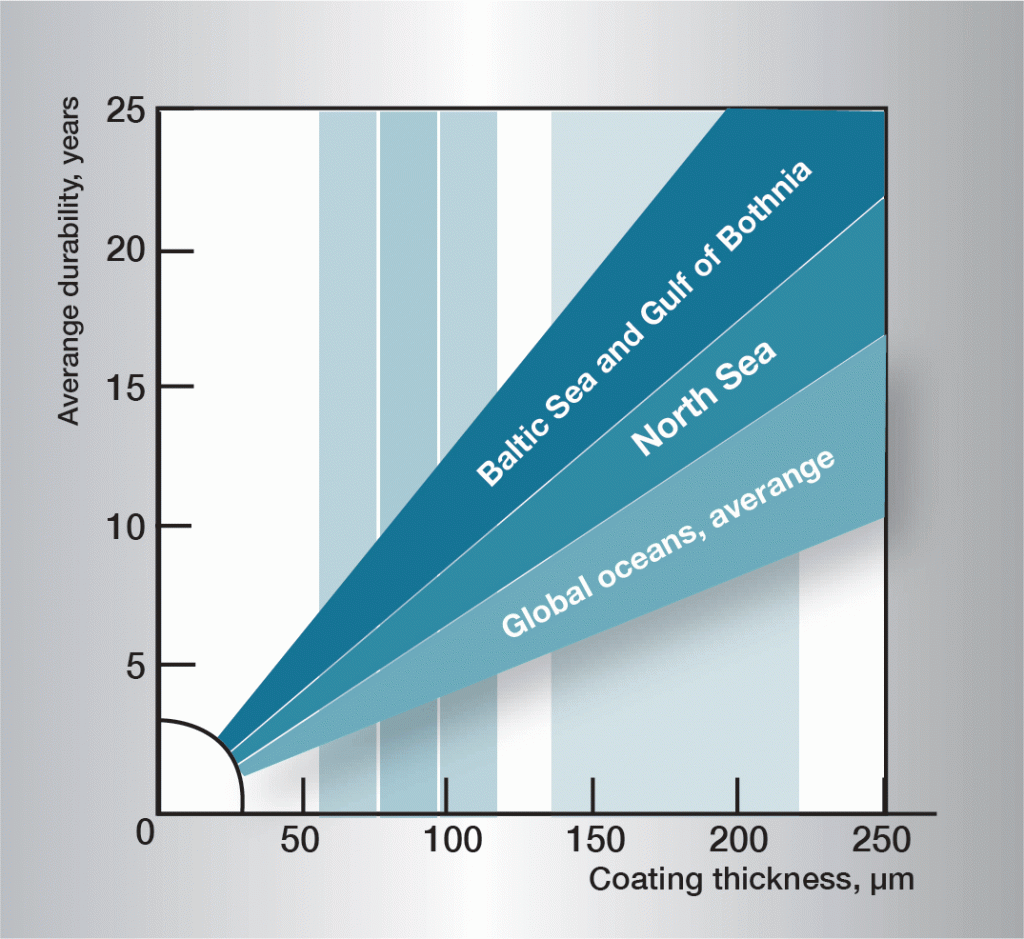
De corrosiesequentie in water is zeer complex en wordt sterk beïnvloed door zeer kleine variaties in de samenstelling van het water. Het is daarom moeilijk algemeen toepasbare regels te geven. De informatie in figuur 3 is gebaseerd op praktijkervaring en geeft richtlijnen voor een aantal verschillende soorten water.
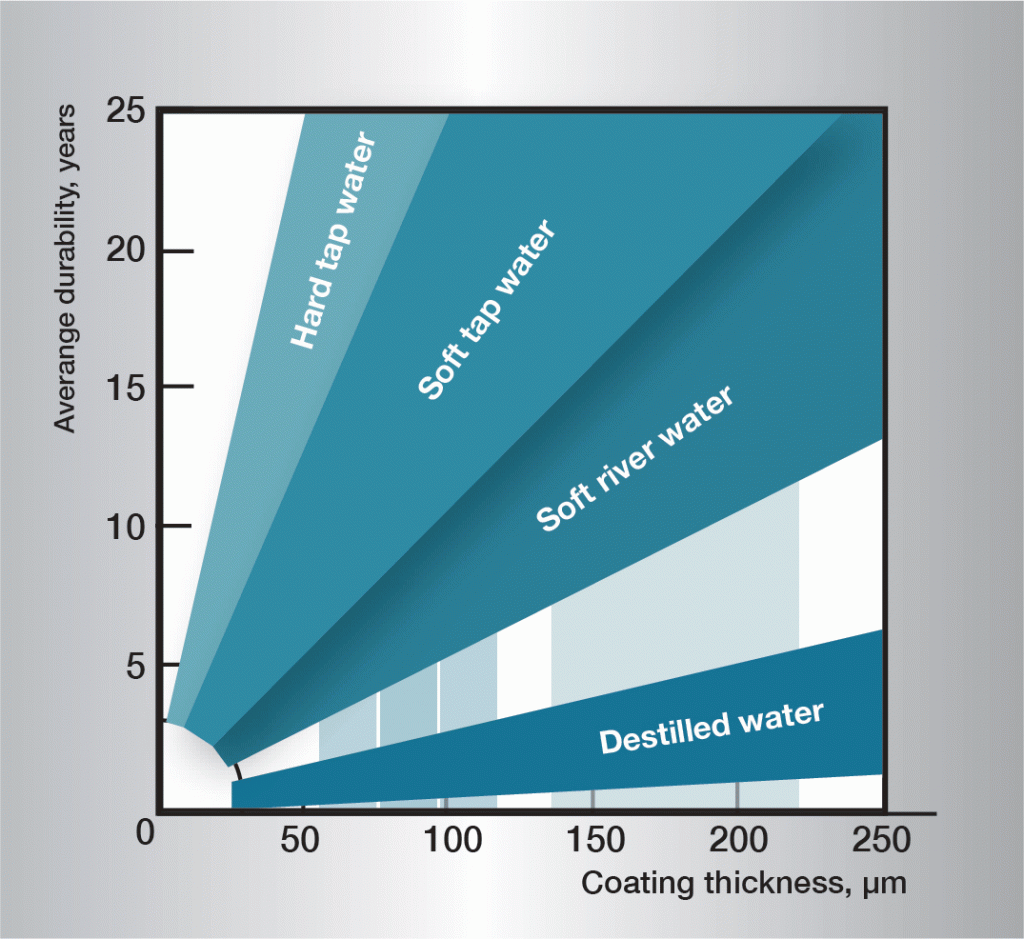
Fig. 3. Levensduur in verschillende wateren.,
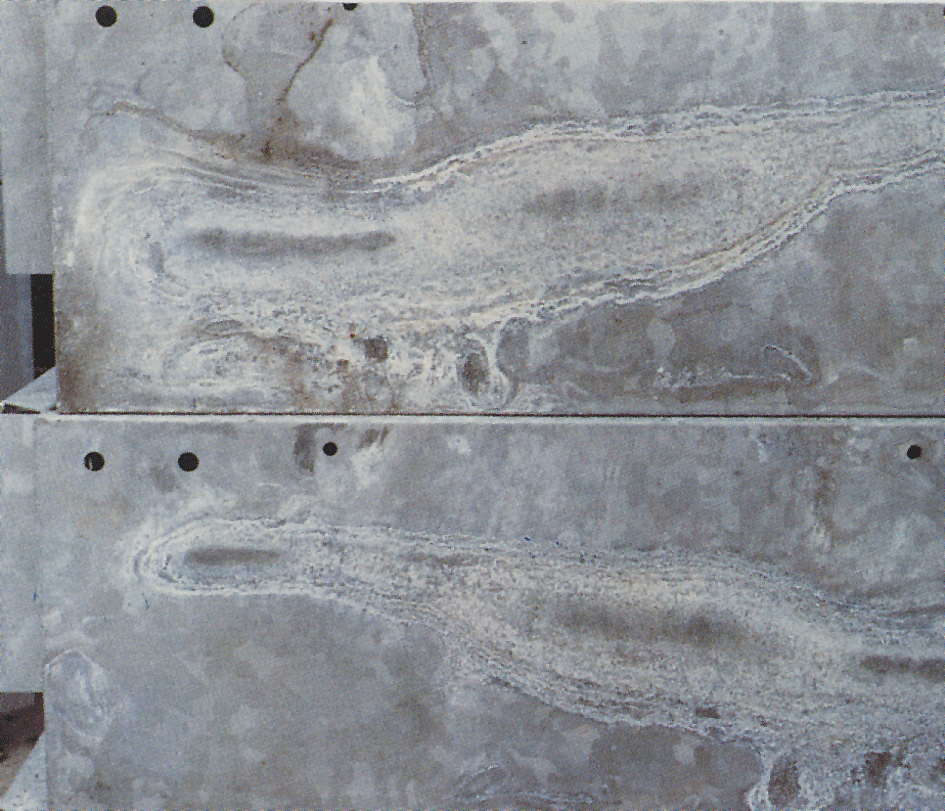
natte-opslag vlek
soms verschijnt er een witte, bloemige en volumineuze laag genaamd natte-opslag vlek, of witte roest gegalvaniseerde vlakken (vijg.4). Witte roest vormt zich op materialen met nieuw verzinkte, glanzende oppervlakken en vooral in spleten tussen dicht verpakte platen, hoekijzer en soortgelijke materialen. Een voorwaarde is dat het materiaal wordt blootgesteld aan condensatie of regenwater in omstandigheden waar het vocht niet snel kan verdampen., Zinkoppervlakken die al een normale beschermlaag van corrosieproducten hebben ontvangen, worden zelden aangevallen. Wanneer zinkcoatings aan lucht worden blootgesteld, worden zinkoxide en zinkhydroxide gevormd. Onder invloed van kooldioxide in de lucht worden deze omgezet in basische zinkcarbonaten. Als de lucht toegang tot het zinkoppervlak beperkt is, zoals bij smalle spleten, dan ontvangt het gebied onvoldoende kooldioxide om de normale laag carbonaten te vormen.
De beitslaag voor natte opslag is volumineus en poreus en slechts losjes aan het zinkoppervlak bevestigd., Als gevolg daarvan bestaat er geen bescherming tegen voortdurende aanvallen. Corrosie kan dus blijven bestaan zolang er vocht op de oppervlakken blijft. Wanneer er een vlek op natte opslag is opgetreden, moet het object worden gestapeld om de oppervlakken snel te laten drogen. Dit zal de aanval stoppen en, met vrije toegang tot lucht, zal de normale beschermende laag worden gevormd. De beits voor natte opslag wordt geleidelijk weggespoeld en de coating krijgt een uiterlijk dat normaal is voor blootgesteld, thermisch verzinkt staal., aangezien dit witte corrosieproduct zeer omvangrijk is (ongeveer 500 maal het zink waaruit het is gevormd), kan het ernstig lijken. Echter, natte opslag vlek heeft vaak weinig of geen betekenis voor de levensduur van de corrosiebescherming. In het geval van zeer dunne coatings, bijvoorbeeld op gegalvaniseerde objecten, kan een ernstige aanval van natte opslag vlek van belang zijn.
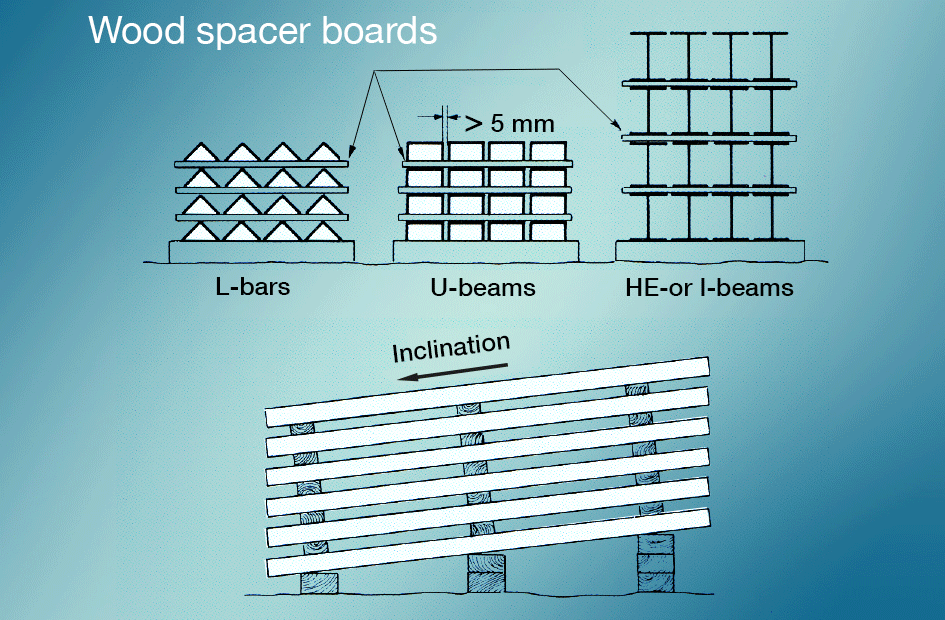
beits voor natte opslag kan het best worden vermeden door te voorkomen dat nieuw verzinkte oppervlakken tijdens het transport in contact komen met regen of condensaat., Materialen die buiten worden opgeslagen, moeten zo worden gestapeld dat het water gemakkelijk kan weglopen en dat alle oppervlakken goed geventileerd zijn (fig. 5). Schilderen na galvaniseren geeft een zeer goede bescherming.
corrosie in de bodem
De corrosieomstandigheden in de bodem zijn zeer ingewikkeld en de variaties kunnen groot zijn tussen verschillende locaties, zelfs die dicht bij elkaar. De bodem kan verweerde producten, vrije of gebonden zouten, zuren en logen, mengsels van organische stoffen, oxiderende of reducerende schimmels, micro – organismen enz.bevatten., Afhankelijk van de structuur, bodem heeft verschillende graden van permeabiliteit voor lucht en vocht. Normaal gesproken is het zuurstofgehalte lager dan in de lucht, terwijl het kooldioxidegehalte hoger is.
Zweedse bodems zijn over het algemeen niet erg agressief. De gemiddelde corrosie voor zink wordt gewoonlijk genomen als 5 µm per jaar. Zeer agressieve bodems worden zelden gezien. In Noord-en westbothnia kan de bodem zwavel bevatten. Ze zijn vaak zwart, maar lichter bij blootstelling aan lucht. In deze bodems, zink corrosie tarieven zijn zeer hoog.een methode om de corrosiviteit van een bodem te bepalen is het meten van de weerstand., Als de resitiviteit van de bodem niet kan worden bepaald, kunnen de vuistregels in Figuur 6 Een maat van leidraad geven. Wat de blootstelling van metalen aan de bodem betreft, is het echter raadzaam deskundig advies in te winnen bij voldoende gekwalificeerde bronnen.

galvanische corrosie

als twee verschillende metalen of legeringen, geheel of gedeeltelijk omgeven door een elektrolyt, met elkaar verbonden zijn, ontstaat een galvanische cel. Welk metaal de anode of kathode wordt, wordt bepaald door hun elektrodepotentialen in de elektrolyt in kwestie. In zeewater, dat overeenkomt met de meeste praktische omstandigheden, nemen sommige metalen en legeringen verschillende posities in op de elektrochemische schaal, zoals afgebeeld in Figuur 7.,
als staal met koper of messing is verbonden, wordt het staal de anode in de cel en corrodeert het. Als staal echter is aangesloten op cadmium, aluminium, zink of magnesium, wordt het de kathode en wordt het beschermd tegen corrosie, terwijl het anodemetaal wordt verbruikt. De galvanische corrosie wordt ook genoemd bimetallic corrosie en wordt gebruikt om onderwaterstructuren tegen corrosie te beschermen, wanneer het kathodische bescherming wordt genoemd.
kathodische bescherming door zinkcoatings
in thermisch verzinkt staal, zink en staal zijn in goed elektrisch contact met elkaar., Als de zinklaag beschadigd is in aanwezigheid van een elektrolyt ontstaat een galvanische cel. De elektrolyt kan condensaat of regenwater zijn. Soms kan de hele structuur worden ondergedompeld in vloeistof. In deze cel wordt het zink de anode of oplossende pool, het blootgestelde staal wordt de kathode en wordt daardoor beschermd tegen corrosie.
in de beginfase is het vaak mogelijk een zwakke ust-vorming te zien op het blootgestelde deel van het staaloppervlak waar de bekleding is beschadigd, maar na verloop van tijd vormen zich witgrijze gebieden die zich geleidelijk over het gehele beschadigde gebied verspreiden., De zinklaag corrodeert en met mate oplosbare zinklegeringen dalen af naar het kathodeoppervlak waar ze het staal beschermen tegen aanhoudende roestaanval. Dit wordt vaak “zelfgenezing” genoemd, wat een beetje een verkeerde benaming is omdat de zinklaag natuurlijk niet wordt hersteld.
door de kathodische bescherming die door het zink wordt gegenereerd, kan roest niet “kruipen” onder de bekleding op het punt van beschadiging, zoals het kan kruipen onder verflagen of bekledingen van edelere metalen dan staal., Zinkcoatings op staal zijn ongebruikelijk, omdat een vrij groot gebied van schade aan de coating geen catastrofaal verlies van roestbescherming veroorzaakt. Het bereik van kathodische bescherming is afhankelijk van de aard van de elektrolyt die de cel creëert. Voor constructies in normale atmosferen is het gebruikelijk om beschermende actie te verwachten over enkele millimeters. In zeewater kunnen echter aanzienlijk grotere afstanden worden verwacht.
Zinkbekledingen in contact met non-ferrometalen
de elektrochemische potentiaalschaal toont aan dat zink minder Nobel is dan de meeste gangbare metalen. Dit betekent dat wanneer zink verbonden is met deze metalen in een galvanische cel het zink is dat de oplossende pool wordt. In principe moeten dergelijke verbindingen daarom waar mogelijk worden vermeden. Een goede methode is om een isolator zoals plastic of rubber te gebruiken bij het gewricht.,
Aluminium en roestvrij staal kunnen vaak rechtstreeks worden aangesloten op gegalvaniseerd materiaal in lucht of vrij droge omgevingen zonder dat er merkbare corrosie optreedt. In water moet echter altijd een isolator worden gebruikt.
koper en koperlegeringen zijn meer elektrisch actief en er komen vaak koperionen vrij die zich over grote oppervlakken verspreiden en een merkbare aanval veroorzaken. Om deze reden mogen deze metalen nooit in contact komen met gegalvaniseerd staal en moet een isolator worden gebruikt.,
Thermisch Verzinkt staal in contact met mortel, gips en hout
vochtige mortel en gips aanval zink. De aanval stopt wanneer het materiaal droogt. Droog of matig vochtig hout, zowel geïmpregneerd als niet geïmpregneerd, kan worden genageld met thermisch verzinkte nagels voor een goed effect. Echter, in het geval van nagels of schroefdraad verbindingen die voortdurend worden blootgesteld aan water een zuurbestendig materiaal heeft de voorkeur. Andere droge bouwmaterialen, zoals minerale wol, vallen zink niet aan.,
verpakking en transport van gegalvaniseerd staal
hoewel een thermisch verzinkte coating bestand is tegen een vrij ruwe behandeling, moet deze tijdens opslag en transport met zorg worden behandeld. In het geval van lange goederen eenvoudige verpakking en binding in bundels beschermt niet alleen tegen mechanische schade, maar het vergemakkelijkt vaak het transport zelf. Het verpakken en binden moet echter op zodanige wijze geschieden dat het risico van natte opslag wordt vermeden. Spacers moeten worden gebruikt om dergelijke aanvallen te voorkomen.