Er zijn vier wetten, bekend als Gas wetten, die beschrijven hoe gassen zich gedragen. De vier wetten zijn Boyle ’s Law, Charles’ s Law, Gay-Lussac ’s Law en Avogadro’ s Law.Jacques Charles, een Franse natuurkundige, ontdekte in de jaren 1780 dat een gas door verhitting met een bepaalde fractie uitdijt. De afbeelding hieronder laat zien hoe het toevoegen van warmte moleculen sneller laat bewegen en raken de zijkanten en deksel met grotere kracht, waardoor het deksel omhoog als het gas uitzet.,
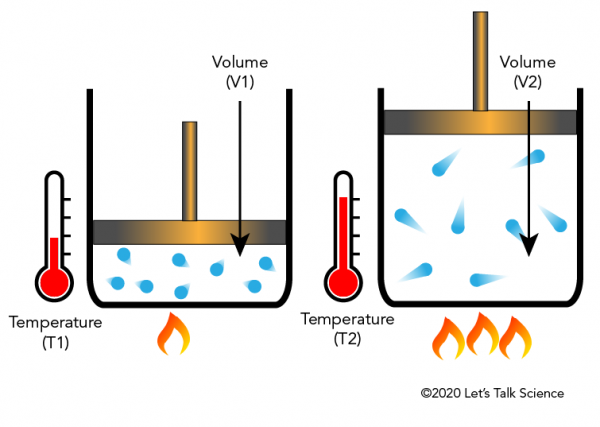
Charles’ wet in het dagelijks leven
om een heteluchtballon te laten rijzen, wordt warmte toegevoegd aan de lucht in de ballon. Door warmte toe te voegen bewegen de moleculen verder van elkaar af.

In alledaagse taal zouden we zeggen dat de lucht binnen uitzet. Wanneer dit gebeurt, neemt de totale dichtheid (massa per volume-eenheid) van de ballon en de lucht erin af. Wanneer de dichtheid van de ballon kleiner wordt dan de dichtheid van de buitenlucht, stijgt de ballon. Omgekeerd zal het volume van een gas krimpen als de temperatuur daalt.
hieronder ziet u vloeibare stikstof die over een groene ballon wordt gegoten. De koude vloeibare stikstof koelt de lucht in de ballon af., Als gevolg hiervan vertragen de luchtmoleculen waardoor het volume van de ballon afneemt.

tijdens de feestdagen heeft iemand die u kent mogelijk een kalkoenthermometer gebruikt. Een kalkoenthermometer zit vast in de kalkoen terwijl hij kookt en duikt dan op als het vlees voldoende gaar is. Hoe werkt dit wonderlijke stukje technologie? Het heeft te maken met de wet van Charles, natuurlijk!, In de kalkoenthermometer zit een kleine hoeveelheid lucht. Als de temperatuur in de kalkoen stijgt, zet de lucht in de kalkoen thermometer uit. Zodra het een bepaald volume bereikt, de top knalt, vertellen de chef-kok dat de kalkoen goed is gekookt.

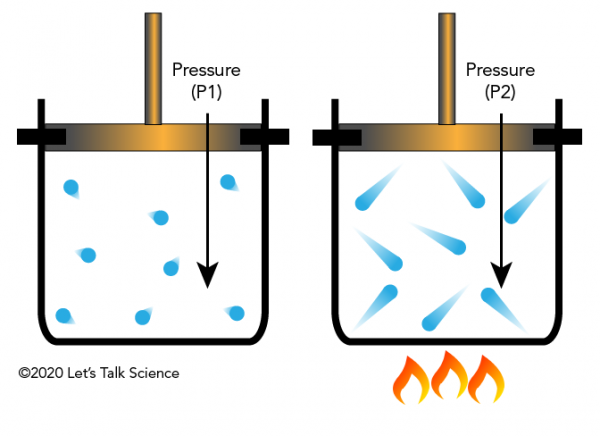
de wet van Gay-Lussac in het dagelijks leven
in een snelkookpan ligt het voedsel dat u wilt koken in water. Als de temperatuur van het vloeibare water wordt verhoogd, wordt waterdamp (water in gastoestand) geproduceerd. Deze damp kan niet ontsnappen aan de snelkookpan – wat betekent dat het volume niet verandert. De druk van de waterdamp blijft stijgen tot de temperatuur van het water en de waterdamp het normale kookpunt van water (100 °C) overschrijden. Bij deze hogere temperatuur kan voedsel veel sneller worden gekookt., Taai vlees komt er ook veel malser uit na het koken in een snelkookpan.

wist u dat de luchtdruk aan de binnenkant van autobanden verandert wanneer de auto wordt gereden? Na het rijden gaat de luchtdruk in de banden van een auto omhoog. Dit komt omdat wrijving (een opdrukkracht) tussen de banden en de weg ervoor zorgt dat de lucht in de banden opwarmt., De lucht kan niet uitzetten omdat de banden in wezen een container met een vast volume zijn, dus de druk neemt toe – Dit is de wet van Gay-Lussac!