leerdoelstellingen
- ken de fysische eigenschappen van ionische en moleculaire stoffen.
de fysische toestand en eigenschappen van een bepaalde verbinding hangen grotendeels af van het type chemische binding dat het vertoont., Moleculaire verbindingen, soms 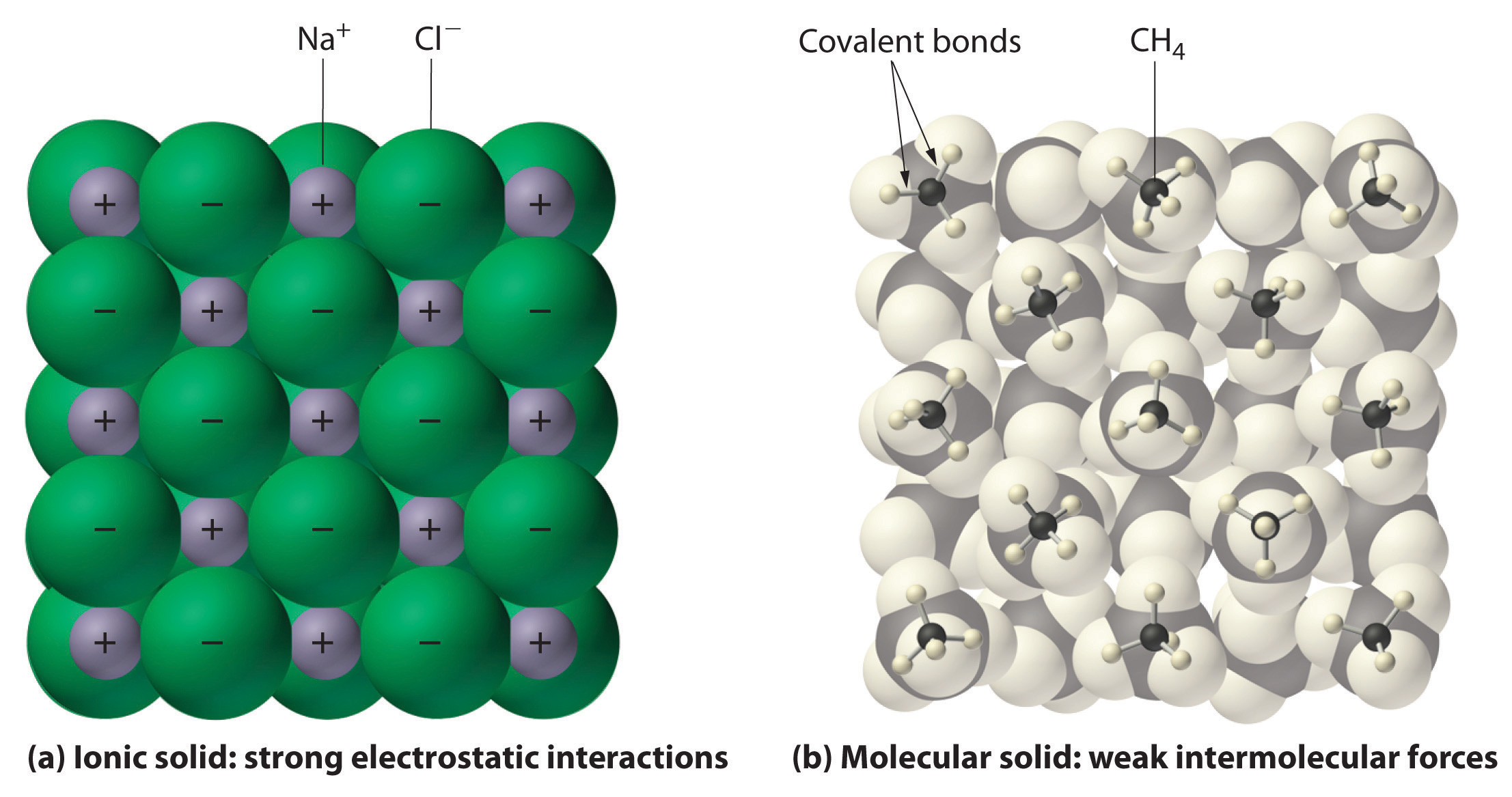 covalente verbindingen genoemd, vertonen een breed scala aan fysische eigenschappen als gevolg van de verschillende soorten intermoleculaire aantrekkingen, zoals verschillende soorten polaire interacties. De smelt-en kookpunten van moleculaire verbindingen zijn over het algemeen vrij laag in vergelijking met die van ionverbindingen. Dit komt omdat de energie die nodig is om de intermoleculaire krachten tussen moleculen te verstoren veel minder is dan de energie die nodig is om de ionenbindingen in een kristallijne ionverbinding te breken (figuur \(\Paginindex{1}\)) ., Ionische vaste stoffen smelten meestal bij hoge temperaturen en koken bij nog hogere temperaturen. Bijvoorbeeld, natriumchloride smelt bij 801 °C en kookt bij 1413 ° C. (ter vergelijking, het moleculaire samengestelde water smelt bij 0 °C en kookt bij 100 ° C.). De oplosbaarheid in water van moleculaire verbindingen is variabel en hangt voornamelijk af van het type intermoleculaire krachten.
covalente verbindingen genoemd, vertonen een breed scala aan fysische eigenschappen als gevolg van de verschillende soorten intermoleculaire aantrekkingen, zoals verschillende soorten polaire interacties. De smelt-en kookpunten van moleculaire verbindingen zijn over het algemeen vrij laag in vergelijking met die van ionverbindingen. Dit komt omdat de energie die nodig is om de intermoleculaire krachten tussen moleculen te verstoren veel minder is dan de energie die nodig is om de ionenbindingen in een kristallijne ionverbinding te breken (figuur \(\Paginindex{1}\)) ., Ionische vaste stoffen smelten meestal bij hoge temperaturen en koken bij nog hogere temperaturen. Bijvoorbeeld, natriumchloride smelt bij 801 °C en kookt bij 1413 ° C. (ter vergelijking, het moleculaire samengestelde water smelt bij 0 °C en kookt bij 100 ° C.). De oplosbaarheid in water van moleculaire verbindingen is variabel en hangt voornamelijk af van het type intermoleculaire krachten.
figuur\ (\Paginindex{1}\) interacties in Ionische en covalente vaste stoffen.,
(a) de positief en negatief geladen ionen in een ionische vaste stof zoals
natriumchloride (NaCl) worden bij elkaar gehouden door sterke elektrostatische interacties.
(b) in deze voorstelling van de verpakking van methaan (CH4) moleculen in vast methaan,
een prototypische moleculaire vaste stof, worden de methaanmoleculen in de vaste stof alleen bij elkaar gehouden door relatief zwakke intermoleculaire krachten, hoewel de atomen in elk methaanmolecuul bij elkaar gehouden worden door sterke covalente bindingen.,
aangezien moleculaire verbindingen uit neutrale moleculen bestaan, is hun elektrische geleidbaarheid over het algemeen vrij slecht, zowel in vaste als in vloeibare toestand. In vaste vorm is een ionische verbinding niet elektrisch geleidend omdat de ionen niet kunnen stromen (“elektriciteit” is de stroom van geladen deeltjes). Als het gesmolten is, kan het echter elektriciteit geleiden omdat zijn ionen vrij door de vloeistof kunnen bewegen (figuur \(\Paginindex{2}\); Video \(\Paginindex{1}\)).,

figuur \(\Paginindex{2}\) natriumchloride smelt bij 801 °C en geleidt elektriciteit wanneer het gesmolten is. (credit: modification of work by Mark Blaser and Matt Evans)
geleidbaarheid van gesmolten zout
Video \(\Paginindex{1}\) Bekijk deze video om een mengsel van zouten te zien smelten en elektriciteit te geleiden.
onderstaande tabel geeft een overzicht van enkele verschillen tussen ionische en moleculaire verbindingen.,>
oplosbaarheid in Water
Een soort moleculaire samenstelling gedraagt zich heel anders dan die beschreven., Een covalente netwerk vaste stof is een verbinding waarin alle atomen met elkaar verbonden zijn door covalente bindingen. Diamant bestaat volledig uit koolstofatomen, elk gebonden aan vier andere koolstofatomen in een tetraëdergeometrie. Het smelten van een covalente netwerk vaste stof wordt niet bereikt door het overwinnen van de relatief zwakke intermoleculaire krachten. Integendeel, alle covalente bindingen moeten worden verbroken, een proces dat extreem hoge temperaturen vereist. Diamant, in feite, smelt helemaal niet. In plaats daarvan verdampt het tot een gas bij temperaturen boven \(3500^ \ text{o} \ text{C}\).,
samenvatting
- de fysische eigenschappen van een materiaal worden beïnvloed door de intermoleculaire krachten die de moleculen bij elkaar houden.
- Ionverbindingen vormen gewoonlijk harde kristallijne vaste stoffen met hoge smeltpunten. Covalente moleculaire verbindingen daarentegen bestaan uit discrete moleculen die bij elkaar worden gehouden door zwakke intermoleculaire krachten en kunnen gassen, vloeistoffen of vaste stoffen zijn bij kamertemperatuur en druk.
- Ionverbindingen in gesmolten vorm of in oplossing kunnen elektriciteit geleiden, terwijl moleculaire verbindingen dat niet doen..,
bijdragers
-
Marisa Alviar-Agnew (Sacramento City College)
-
Paul Flowers (University of North Carolina – Pembroke), Klaus Theopold (University of Delaware) en Richard Langley (Stephen F. Austin State University) met bijdragende auteurs. Tekstboek content geproduceerd door OpenStax College is gelicenseerd onder een Creative Commons Attribution License 4.0 licentie. Gratis downloaden op http://cnx.org/contents/85abf193-2bd…[email protected]).,
-
CK-12 stichting door Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson en Jean Dupon.