Atomer og Lys Energi
studier av atomer og deres egenskaper overlapper flere differentsciences. Kjemikere, Fysikere og Astronomer alle må forstå themicroscopic skala på hvor mye av Universet funksjoner for å koke «større bilde».,
i Atom
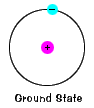 |
bakken tilstand av et elektron, energi nivå itnormally ligger i, er tilstanden til lavest mulig energi for at elektronet. |
| Det er også en maksimal energi at hvert elektron canhave og fortsatt være en del av sin atom. Utover det energi, electronis ikke lenger bundet til kjernen av et atom, og det anses vare ionisert., | 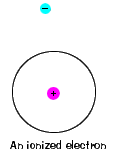 |
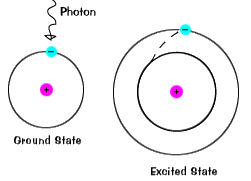 |
Når et elektron midlertidig inntar en energi tilstand større enn itsground staten, det er i en opphisset tilstand.Et elektron kan bli glade hvis det er gitt ekstra energi, for eksempel hvis itabsorbs et foton, eller pakke av lys, eller kolliderer med et nærliggende atom eller partikkel. |
Lys Energi
illustrasjonene på denne siden er forenklede versjoner av ekte atomer,selvfølgelig. Ekte atomer, til og med en relativt enkle som hydrogen,har mange forskjellige orbitals, og så er det mange mulige energieswith ulike første og siste stater., Når et atom er i en excitedstate, elektronet kan slippe helt til bakken staten på en gang,eller stopp på veien i et middels nivå.
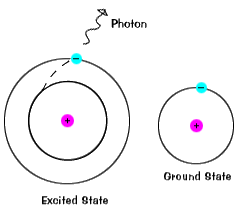 |
Elektroner ikke bo i spent usa på veldig lenge – de soonreturn til deres bakken stater, sender ut et foton med sameenergy som den som ble absorbert., |
Identifisere Enkelte Typer Atomer
Overganger mellom de ulike orbitals er unike for hvert element fordi theenergy nivåer er entydig bestemt av protoner og nøytroner i thenucleus. Vi vet at ulike elementer har forskjellige tall ofprotons og nøytroner i deres kjerner. Whenthe elektroner i en viss atom gå tilbake til lavere orbitalsfrom spent stater, fotoner de slipper ut, har energi som arecharacteristic av den slags atom., Dette gir eachelement et unikt fingeravtrykk, noe som gjør det mulig å identifisere elementspresent i en beholder med gass, eller enda en stjerne.
Vi kan bruke verktøy som den periodiske tabell over elementene for å finne ut exactlyhow mange protoner, og dermed elektroner et atom har. Først av alt, vi knowthat for et atom til å ha en nøytral ladning, det må ha samme antall ofprotons og elektroner. Hvis et atom mister eller får elektroner, det becomesionized, eller belastet. Den periodiske tabellen vil gi oss atomnummer ofan element. Atomnummeret forteller oss hvor mange protoner en atomhas., For eksempel, hydrogen har et atomnummer av en – som betyr at det hasone proton, og dermed ett elektron – og har faktisk ingen nøytroner.
For Studenten
Basert på tidligere beskrivelse av atom -, tegne amodel av hydrogen atom. Den «vanlige» modellen av et atom er knownas den Bohr-modellen.
Ulike former av samme grunnstoff som skiller seg bare ved numberof nøytroner i sin kjerne kalles isotoper. De fleste elementene havemore enn en naturlig forekommende isotop., Mange flere isotoper har beenproduced i kjernefysiske reaktorer og vitenskapelige laboratorier. Isotoper usuallyaren ikke veldig stabil, og de har en tendens til å gjennomgå radioaktiv nedbrytning untilsomething som er mer stabil, er dannet. Du kan bli kjent med elementuranium – det har flere ustabile isotoper, U-235 å være en av de mostcommonly kjent. De 235 betyr at denne formen for uran har 235 neutronsand protoner kombinert. Hvis vi så opp uran er atomnummer, og substractedthat fra 235, kan vi beregne antall nøytroner som isotopen har.,
Her er et annet eksempel – karbon skjer vanligvis i form av C-12 (c-12), som er 6 protoner og 6 nøytroner, selv om en isotop er C-13, med 6protons og 7 nøytroner.
For Studenten
Bruk den periodiske tabellen og navn av elementene nedenfor for å finne ut hvor mange protoner, nøytroner og elektroner de har.Tegn en modell av et atom av følgende element: silicon-28,magnesium-24, svovel-32, oksygen-16, og helium-4.,
For Studenten
ved Hjelp av tekst, angi følgende vilkår: energi nivåer, absorpsjon, utslipp, opphisset tilstand, bakken staten, ionisering,atom, element, atommasse, atomnummer, isotop.
En Ekstra Oppmerksom på kvantemekaniske Arten av AtomerMens Bohr atom som er beskrevet ovenfor er et flott wayto lære om strukturen av atomer, det er ikke den mest nøyaktige måten tomodel dem., Selv om hver orbital har en presis energi, theelectron er nå tenkt som blir smurt ut i en «elektron cloud»rundt kjernen. Det er vanlig å snakke om den midlere avstand til thecloud som radius av elektronets bane.Så bare husk, vi vil holde ord «orbit» og «satellitter», selv om vi arenow bruke dem til å beskrive ikke en flatskjerm baneplanet, men aregion hvor et elektron har en sannsynlighet for å bli. Elektroner er holdt i nærheten thenucleus av elektrisk tiltrekning mellom kjernen og elektronene.,Holdt det på samme måte som de ni planetene bo i nærheten av Solen i stedet ofroaming galaxy. I motsetning til solenergi system, hvor alle planetene’ orbitsare på samme plan, elektroner i bane er mer tre-dimensjonal. Eachenergy nivå på et atom har en annen form. Det er mathematicalequations som vil fortelle deg sannsynligheten for at elektronet er locationwithin som bane. La oss vurdere thehydrogen atom, som vi allerede tegnet en Bohr-modellen av.,
tekst og bilder i denne delen var tilpasset fra Dave Slaven side onThe Atom (se Referanser nedenfor). |

