Nucleophilic Substitusjon av Hydroksyl Gruppe
kjemisk oppførsel av alkyl halides kan brukes som en referanse i å oppdage analogt substitusjon og eliminasjon, reaksjoner av alkohol. Daglig forskjell, selvfølgelig, er en endring i den forlater anion fra halide å hydroxide. Fordi oksygen er litt mer electronegative enn klor (3.5 vs. 2.8 på Pauling skala), C-O bond er forventet å være mer polare enn en C-Cl bond., Videre er et selvstendig mål på elektrofil egenskaper av karbon-atomer fra deres NMR kjemiske skift (både 13C og alfa protoner) viser at oksygen og klor substituenter utøve en lignende elektron-uttak innflytelse når bundet til sp3 hybridiserte karbon atomer. Til tross for dette lovende bakgrunn bevis, alkoholer ikke gjennomgå den samme SN2 reaksjoner ofte observert med alkyl halides. For eksempel, den raske SN2 reaksjon på 1-bromobutane med natrium cyanid, som vist nedenfor, har ingen parallell når 1-butanol er behandlet med natrium cyanid., Faktisk, etylalkohol er ofte brukt som løsemiddel for alkyl halide substitusjon reaksjoner som dette.
CH3CH2CH2CH2–Br + Na+) CN(–)  CH3CH2CH2CH2–CN + Na+) Br(–)
CH3CH2CH2CH2–CN + Na+) Br(–)
CH3CH2CH2CH2–OH + Na+) CN(–)  Ingen Reaksjon
Ingen Reaksjon
Den viktigste faktoren her er stabiliteten av forlater anion (bromide vs. hydroxide)., HBr er en mye sterkere syre enn vann (med mer enn 18 størrelsesordener), og denne forskjellen gjenspeiles i reaksjoner som genererer sine respektive konjugat baser. Den svakere base, bromide, er mer stabil, og utgivelsen i en substitusjon eller eliminering reaksjon er mye mer gunstig enn hydroxide ion, en sterkere og mindre stabil base.
Et klart skritt i retning av å forbedre reaktivitet av alkoholer i SN2 reaksjoner ville være å endre –OH funksjonell gruppe på en måte som forbedrer stabiliteten som forlater anion., En slik endring er å gjennomføre byttet reaksjon i en sterk syre, konvertere –OH-til –OH2(+). Fordi hydronium ion (H3O(+)) er en mye sterkere syre enn vann, konjugat base (H2O) er en bedre forlate gruppen enn hydroxide ion. Det eneste problemet med denne strategien er at mange nucleophiles, inkludert cyanid, er deaktivert av protonation i sterke syrer, effektivt fjerner nucleophilic co-reaktant nødvendig for substitusjon., Den sterke syrer HCl, HBr og HI er ikke underlagt dette problemer fordi deres kobling baser er godt nucleophiles og er enda svakere baser enn alkohol. Følgende ligninger illustrere noen substitusjon reaksjoner av alkoholer som kan bli berørt av disse syrer. Som med alkyl halides, den nucleophilic substitusjon av 1º-alkoholer innbetalinger av en SN2 mekanisme, mens 3º-alkoholer reagerer med en SN1 mekanisme. Reaksjoner av 2º-alkohol kan skje ved både mekanismer og ofte produsere noen omorganisert produkter., Tallene i parentes ved siden av mineral syre formler representerer vekt andel av en konsentrert vandig løsning, i hvilken form disse syrer er normalt brukt.
Selv om disse reaksjonene er noen ganger referert til som «syre-catalyzed,» dette er ikke strengt riktig. I den samlede transformasjon, en sterk HX syre er konvertert til vann, en meget svak syre, så i hvert fall en stoichiometric mengde HX er nødvendig for en fullstendig konvertering av alkohol til alkyl halide., Nødvendigheten av å bruke tilsvarende mengder av svært sterke syrer i denne reaksjonen som begrenser dens nytteverdi for enkel alkoholer av den typen som er vist ovenfor. Alkoholer med syre-følsomme grupper ikke gjør det, selvfølgelig, tåle slik behandling. Likevel, tanken på å endre -OH funksjonell gruppe for å forbedre sin stabilitet som forlater anion kan søkes i andre retninger. Det følgende diagrammet viser noen endringer som har vist seg effektive. I hvert tilfelle hydroksyl gruppe er konvertert til en ester av en sterk syre. De to første eksemplene viser klassifisering estere som er beskrevet tidligere., Den tredje og fjerde eksemplene viser dannelsen av en phosphite ester (X representerer den gjenværende bromines eller flere alkohol substituenter) og en chlorosulfite ester, henholdsvis. Alle disse forlater grupper (blåfarget) har konjugat syrer som er mye sterkere enn vann (av 13 til 16 krefter av ti), og dermed forlater anion er tilsvarende mer stabil enn hydroxide ion. Den mesylate og tosylate forbindelser er spesielt nyttige fordi de kan brukes i substitusjonsbehandling reaksjoner med et bredt utvalg av nucleophiles., Den viderekommende produsert i reaksjoner av alkoholer med fosfor tribromide og thionyl klorid (siste to eksempler) er sjelden isolert, og disse reaksjonene fortsette å produsere alkyl bromide og klorid produkter.
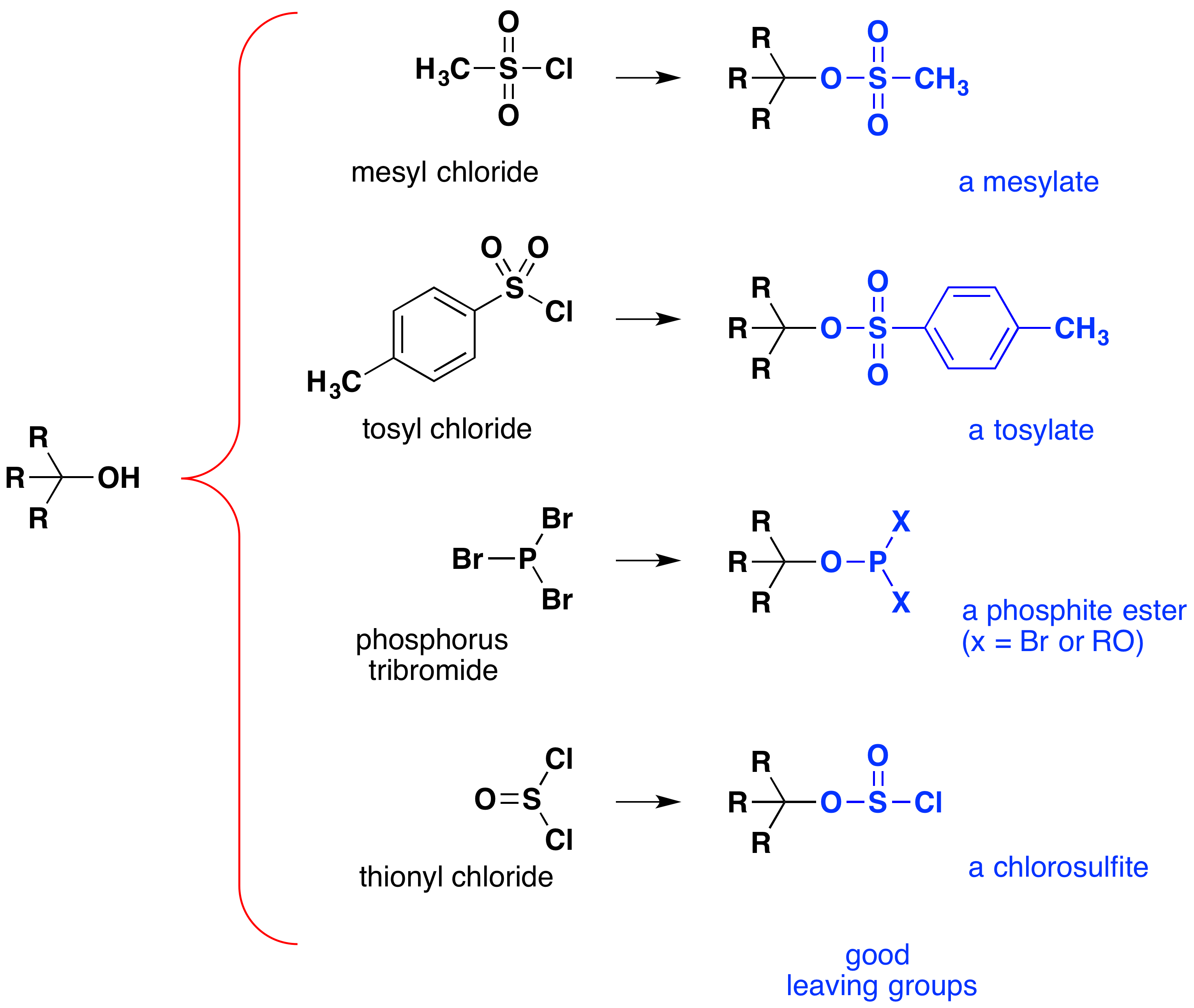
viktigheten av sulfonate ester intermediater i generelle nucleophilic substitusjon reaksjoner av alkohol kan illustreres ved følgende konvertering av 1-butanol å pentanenitrile (butyl cyanid), en reaksjon som oppstår ikke med alkohol alene., Fosfor og thionyl halides, på den annen side, bare lov til å konvertere alkoholer til tilsvarende alkyl halides.,
| CH3CH2CH2CH2–OH + CH3SO2Cl | pyridine
|
CH3CH2CH2CH2–OSO2CH3 | Na(+) CN(–)
|
CH3CH2CH2CH2–CN + CH3SO2O(–) Na(+) |
Some examples of alcohol substitution reactions using this approach to activating the hydroxyl group are shown in the following diagram., De første to tilfeller tjene til å forsterke det faktum at sulfonate ester derivater av alkohol kan erstatte alkyl halides i en rekke SN2 reaksjoner. De neste to tilfeller demonstrere bruken av fosfor tribromide i konvertering av alkohol til bromider. Denne reagensen kan brukes uten tilsatt base (f.eks. pyridine) fordi fosfor syre produktet er en svakere syre enn HBr. Fosfor tribromide er best brukt med 1º-alkohol fordi 2º-alkohol ofte etter omorganisering av-produkter som følge av konkurrerende SN1 reaksjoner., Vær oppmerksom på at ether oksygen i reaksjon 4 er ikke berørt av denne reagensen, mens alternativ syntese ved bruk av konsentrert HBr cleaves ethers. Fosfor trichloride (PCl3) konverterer alkoholer å alkyl klorider på en lignende måte, men thionyl klorid er vanligvis foretrukket for denne utviklingen, siden de uorganiske produkter er gasser (SO2 & HCl). Fosfor triiodide er ikke stabil, men kan være generert i situ fra en blanding av rødt fosfor og jod og handlinger for å konvertere alkoholer å alkyl iodides., Det siste eksemplet viser reaksjon av thionyl klorid med en chiral 2º-alkohol. Tilstedeværelsen av en organisk base for eksempel pyridine er viktig fordi det gir en betydelig konsentrasjon av klorid ion nødvendig for den endelige SN2 reaksjon av chlorosufite middels., I fravær av en base, chlorosufites brytes ned ved oppvarming til å gi de forventede alkyl klorid med oppbevaring av konfigurasjon
Tertiære alkoholer er ikke ofte brukt for substitusjon reaksjoner av den typen som omtales her fordi SN1 og E1 reaksjon stier er dominerende og er vanskelig å kontrollere.

viktigheten av sulfonate estere som intermediater i mange substitusjon reaksjoner kan ikke overvurderes., Et grundig bevis på configurational inversjon som oppstår ved innbytte området i SN2 reaksjoner gjør bruk av slike reaksjoner. Et eksempel på et slikt bevis er vist nedenfor. Forkortelser for de vanligst brukte sulfonyl derivater er gitt i følgende tabell.
| Sulfonyl Gruppe | CH3SO2– | CH3C6H4SO2– | BrC6H4SO2– | CF3SO2– |
|---|---|---|---|---|
| Navn & Abbrev., | Mesyl eller Ms | Tosyl eller Ts | Brosyl eller Bs | Trifyl eller Tf |
Inversjon Bevis

For en mer utfyllende drøfting av hydroksyl substitusjon reaksjoner og en beskrivelse av andre selektive metoder for denne transformasjonen, Klikk Her.
Bidragsytere
- William Reusch, Professor Emeritus (Michigan State U.,), Virtual Textbook of Organic Chemistry