Innledning
i Løpet av vinteren, noen ganger hudleger motta asymptomatiske pasienter, med ingen spesifikke lesjoner andre enn kanskje noen post-inflammatorisk misfarging, men med et desperat behov for hjelp. De begynner å fortelle historien om en rekke papler eller blemmer som vises på huden etter den første intens soling av året., Sammen med lesjoner, en forferdelig kløe starter og øker i takt med spredning av sykdommen, etter den neste soleksponering, noen ganger forverres av en slags brennende følelse. Likevel, dette folk er modell sun søkere og fortsette å nyte sol hele sommeren, venter for papler å gradvis svekkes og forsvinner. De viktigste spørsmålene er: hvordan kan jeg unngå dette? Hvorfor jeg får dette problemet siden «5» år nå, men jeg har aldri hatt det før?,
Vi er mest sannsynligvis å gjøre med polymorf lys utbrudd (PLE) og, etter ønsker fra våre pasienter, medisinsk forskning har i hovedsak vært fokusert på forebyggende strategier blir i dag ganske tilfredsstillende. På den andre siden, den andre og gjerne mindre utforsket spørsmål, er fortsatt uklart, med mindre flere brikker har blitt lagt til dette ganske komplisert puslespill. Målet med denne korte gjennomgangen er å fortsette den mest nylige fremskritt i PLE mulige mekanismer og de mest brukte protokollene for forebygging eller behandling.
Pathophisiology av Polymorfe Lys Utbrudd: Hva er Nytt?,
PLE er den vanligste lysfølsomme lidelse, preget av en tilbakevendende utbrudd av ikke-arrdannelse pruritisk erythematous papler, blemmer eller plaketter (Figur 1) som utvikler seg i løpet av timer av ultrafiolett stråling (UVR) eksponering av pasientens hud. Sykdommen er avhengig av genetisk mottakelighet, samt miljø-komponent, slik som type eksponering. PLE ser ut til å klynge i familier: det har blitt anslått at forekomsten av PLE var 21 og 18% i eneggede og toeggede tvillinger, henholdsvis (1)., Videre, en positiv familie historie av PLE i første-graders slektninger var til stede i 12% av berørte tvillingpar hensyn til 4% av upåvirket tvillingpar (p < 0.0001). Den probandwise samstemmighet i eneggede var bedre enn hos toeggede tvillingpar (0.72 vs. 0.30, henholdsvis), som viser en sterk genetisk effekt (1). Mange gener som er av potensiell interesse i patogenesen av PLE har blitt undersøkt med generelt ulønnsomt resultater., Ved hjelp av segregering analyse, det har blitt anslått at 72% av den BRITISKE befolkningen bære en lav penetrance PLE mottakelighet allelet (2).
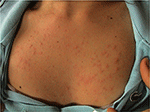
Figur 1. Kliniske bildet av polymorfe lys utbrudd i en ung kvinne.
Svikt i Apoptosis: det er Mulig Bilde-Indusert Neo-Antigener
I en fersk genome-wide uttrykk analyse, bare 16 gener var differentially uttrykt mellom PLE og friske kontroller etter UV-bestråling hensyn til kontroll (3)., Av disse genene, 14 viste lavere uttrykk i PLE pasienter, mens to resulterte over-uttrykk. Blant de 14 gener med lavere uttrykk i PLE er: utfylle 1s subunit (C1s), gatefeier reseptor B1 (SCARB1) fibronektin (FN1), immunoglobulin superfamily medlem 3 (IGSF3), caspase-1 (CASP1) og paraoxonase 2 (PON2), alle gener assosiert med apoptotic celle klaring. Det har vært antatt at protein modifikasjoner under apoptotic celle klaring kan føre til potensielle auto-antigen dannelse (4)., Deretter redusert til uttrykk i PLE pasienter av gener som er koblet til denne prosessen kunne representere en mulig auto-antigen kilde, samt en avgjørende fase i innføringen av den autoimmune prosessen som fremmer sykdommen (3). I henhold til disse funnene, Kuhn et al. viste opphopning av apoptotic celler i PLE pasienter bestrålt enten med 1,5 Minimal Erythema Dose (MED) av UVB, eller 60-100 J/cm2 av UVA1, sammenlignet med kontroller (5).,
Immunitet: Toleranse er Feil
Auto-antigener som stammer fra den ineffektive klarering av apoptotic celler, er trolig tatt opp av dendrittiske celler (DCs) og presentert for naive T-celler (cytotoksiske og helper) deretter forvandlet i auto-reaktive T-celler (6, 7). Dette delvis svikt i apoptosis bidrar, sammen med utilstrekkelig immunsuppresjon etter UV-stråling, til antigen anerkjennelse og presentasjon, som fører til klinisk manifestasjon typisk for PLE pasienter (8)., Faktisk, svikt i normale UVR-indusert immunsuppresjon har vist seg som den viktigste immunologiske avvik i PLE, forklart i begynnelsen av permanens av Langerhans celler (LCs) i overhuden. Denne over-aktivering av immunsystemet, som unnslipper den funksjonelle UV-indusert toleranse, er trolig ansvarlig for redusert hudkreft prevalens i PLE pasienter (9). På den annen side, den samme mekanismen er skyldig til svikt av allergisk kontakteksem (ACD) undertrykkelse, etter UVR eksponering (10).,
Inflammatorisk Vei: Forsinket-Type overfølsomhetsreaksjon
Den immunologiske mekanismene som er involvert i PLE, med meglere fra det medfødte og det adaptive immunforsvaret, er svært lik, enten fra den histologiske eller biokjemiske synspunkt, til ACD seg. I kraft tidlig på syttitallet, Epstein første angitt PLE som en forsinket-type overfølsomhetsreaksjon (DTHR) for å udefinert UVR-indusert kutan antigen (11). Nylig, for å forsterke dette konseptet, noen av inflammatoriske mediatorer som er involvert i ACD har blitt demonstrert også i PLE., For eksempel, IL-1 familie (12, 13), en voksende gruppe av cytokiner som spiller flere roller i immunforsvaret regulering og betennelse (14), som er involvert også i ACD patogenesen (12, 15), har blitt utforsket, også i PLE (16). IL-36α og IL-36γ, pro-inflammatoriske medlemmer av IL-1-familien ble økt i PLE hensyn til kontroller, som for ACD prøver, men IL-36γ var mye bedre i PLE enn i ACD (16). Konstituert gjennom den felles reseptor består av IL-36R og IL-1R/AcP (IL-1RL2), IL-36α, IL-36β, og IL-36γ aktivere NF-kB og MAPKs, fremme inflammatoriske reaksjoner., Økningen av IL-36s i huden og perifert blod av PLE pasienter indikerer aktivering av lokal og systemisk immunrespons, som finnes i flere av inflammatorisk hudsykdommer (15, 17, 18). Sannsynligvis er det koblingen mellom IL-36s og UVR eksponering er representert ved parakrine pro-inflammatorisk signal om toll som reseptor (TLR)-3 aktivering, på grunn av utslipp av RNA av nekrotisk keratinocytes (19). Faktisk, svikt i apoptotic klarering i PLE, med overflod av mobilnettet avfall, kan være ansvarlig for en forsterkning av denne «varsel-signal.,»
Videre, IL-36s kunne bidra til å forsterke det medfødte immunsystemet signal og den påfølgende inflammatorisk cascade, fremme antimikrobielle peptider (Ampere) (20).
Inflammatorisk Vei: Forsterkere og Microbiome
Som i stor grad er undersøkt i flere hud inflammatoriske prosesser, disse meklerne, navngitt som defensins (α og β), cathelicidin (LL37), ribonuclease 7 (RNase7) og psoriasin (S100A7), i lys av den ubalansen forårsaket av UVR på keratinocytes og hud microbiome, har også blitt undersøkt i PLE (21, 22). Patra et al., har funnet ut at uttrykket av psoriasin, RNase7, HBD-2, og LL-37 ble økt i PLE lesional huden, mens HBD-3 ble redusert. Vurderer huden overflaten som et «multietnisk verden», uten å glemme den viktige rollen keratinocytes, kan vi ikke utelukke at Forsterkere utslipp kan bestemmes ved endring i microbiome komponenter etter UV-interaksjon (23). Faktisk, microbiome kunne representere kilden, direkte eller indirekte, av de som ennå uoppdaget UVR-indusert antigener dannet i PLE pasienter, noe som fører til keratinocyte skade., Som en konsekvens, LL-37, også forårsaket av UVB, IFNy, TNF-α, IL-6, vil kunne representere en potensiell indirekte driver av PLE (23). Det kan danne aggregater med selv-nukleinsyre i stand til å aktivere pDCs: i psoriasis det har blitt anerkjent som den viktigste autoantigen (24). Selv om det i PLE pasienter en fullstendig fravær av pDCs har blitt rapportert (25), en autoimmun miljø eksisterer, og LL-37 kunne spille en avgjørende rolle, og forårsaker andre inflammatoriske trasé. I Figur S1 (Supplerende Materiale), konsepter som er uttrykt ovenfor, er visualisert i en tegneserie.
Behandling av Polymorfe Lys Utbrudd: Hva er Nytt?,
Den første linjen av behandling for PLE inkluderer sol unngåelse, solkremer og topikale kortikosteroider (26). For alle pasienter forebyggende ledelse er grunnleggende under solfylte været, ved å unngå intens UVR eksponering og bruk av verneutstyr, samt påføring av solkrem, spesielt i løpet av de første eksponering av året. Ny generasjon bredspektret solbeskyttelse, med høy solfaktor for UVB (SPF), sammen med lengre bølgelengde UVA-beskyttelse, har vært rapportert å gi hel eller delvis beskyttelse i opp til 90% av PLE pasienter (27, 28)., Bruk av p-antioksidanter og nikotinamid kan representere en ekstra gyldig forebyggende tiltak for disse pasientene. De gunstige effektene av nikotinamid har blitt undersøkt i en ukontrollert studie av 42 pasienter, hvor 60% av dem rapporterte fullstendig avskaffelse av symptomer når du tar 2-3 g nikotinamid daglig, før soleksponering (29). Videre, et utdrag av den tropiske fern Polypodiumleucotomos [PL) har vist seg å utøve både potent antioksidant og immunmodulerende effekter., Når administreres på 480 mg/daglig før soleksponering det betydelig redusert hudreaksjoner og subjektive symptomer (30, 31). Om topikale kortikosteroider, selv om ingen studier har blitt gjort for å fastslå deres effekt i PLE, de er mye brukt for å redusere kløe (26). Den andre linjen av behandlinger for PLE inkluderer systemiske kortikosteroider og bilde(kjemoterapi)terapi (26). I en randomisert, dobbelt-blind, placebo-kontrollert studie (32) forfatterne foreslo bruk av 25 mg prednisolon daglig i 4-5 dager i begynnelsen av utbruddet., Selv om potensialet for langsiktige bivirkninger av gjentatte kurs av prednisolon må vurderes, det kan anbefales for pasienter som lider av sporadiske angrep av PLE, i fravær av kontraindikasjoner. I mildere tilfeller av PLE, en selv-condition program av graduate eksponering for sollys i vår, kan være tilstrekkelig (33). Mens, i mer alvorlige tilfeller, medisinsk tilsyn condition/desensitivisering behandling kan være mer hensiktsmessig., Et kurs i psoralen og UVA-terapi (PUVA), narrowband (NB)-UVB-eller bredbånd (BB)-UVB-lysbehandling, vanligvis administrert i tidlig på våren, kan være effektiv så vel som forebyggende behandling (26). Behandling protokollen generelt består av ett kurs av lysbehandling/photochemotherapy over 5-6 uker. Starter doser avhengig av minimal erythemal dose (MED) eller minimum phototoxic dose (MPD), og er ofte 50-70% av disse har målt terskler med trinnvis øker., For å opprettholde den fordel ervervet med desensitizing terapi, en vanlig sol eksponering gjennom sommeren anbefales, ellers herding kan være tapt i løpet av 4-6 uker. I behandlingen av PLE, NB-UVB bør være foretrukket å PUVA (styrke anbefaling D; nivå av bevis 4), på grunn av lavere risiko for photocarcinogenesis, ingen risiko for kvalme eller andre bivirkninger forbundet med inntak av MOPP, og du trenger ikke å bruke post-behandling øyevern. Imidlertid, PUVA bør vurderes, før andre systemiske behandlinger, hvis NB-UVB har mislyktes eller det har tidligere utløste utbrudd., I effekt, som beskrevet nedenfor, virkningen er bevist i flere lysbehandling regimer (BB-UVB, NB-UVB og PUVA), og bivirkninger, på sikt av utslett provokasjon, erytem og kløe ble funnet å være mer vanlig med UVB enn med PUVA (34). Som oppsummert i litteraturen, virkningen av PUVA resulterer i en 65-100% photoprotection pris (34)., Flere komparative studier har vært utført, men fra bare randomisert kontrollert studie mellom PUVA og NB-UVB-pluss placebo tabletter, tre ganger i uka i 5 uker, ingen signifikant forskjell i effekt dukket opp, vurderer forekomsten av PLE eller utendørs aktivitet restriksjon (35). I 10 år retrospektiv gjennomgang, rapportert av Mann et al. (36), 170 pasienter med moderat til alvorlig PLE mottatt PUVA og/eller UVB lysbehandling. I detalj, 8 pasienter fikk PUVA, 128 NB-UVB, 5 BB-UVB, og 29 pasienter, som ikke klarte å svare på en tilfredsstillende måte for å NB-UVB, ble gitt PUVA følgende år., Egenevalueringer var laget av alvorlighetsgraden og frekvensen av PLE episoder ble rapportert på oppfølging besøk i høst, eller i løpet av våren. God eller moderat forbedring ble rapportert i 88% av pasientene behandlet med PUVA og i 89% som fikk UVB. Av de pasientene som ble behandlet med både PUVA og NB-UVB, de fleste foretrukket PUVA. I en annen 14-år retrospektiv studie på 79 pasienter som behandles med lysbehandling (37), effekt, målt i løpet av den følgende sommer på sikt av photoprotection med fullstendig/delvis remisjon, var 65% for PUVA, 82% for BB-UVB og 83% for UVA alene., I dette tilfellet behandling med PUVA var forbeholdt mer alvorlige PLE former.
De mekanismer som lysbehandling induserer photoprotection er ikke fullt ut forstått.
Men i de siste årene har mange fremskritt har blitt utført. I tillegg til den kjente effekter på melaninization og epidermal fortykkelse av lysbehandling, et bredt spekter av UV-indusert immunmodulerende og anti-inflammatoriske egenskaper er rapportert (38)., Både UVB-og UVA-modulere adhesion molecule uttrykk og indusere løselig meklere, slik som a-melanocyte-stimulerende hormon, IL-10 (som undertrykker produksjonen av interferon-γ) og prostaglandin E2, som explicate anti-inflammatorisk handlinger, hindrer aktivering av T-celler og fremme apoptosis av huden infiltrere T-celler (34). Videre har det blitt vist at forebyggende UV photohardening i PLE pasienter gjenoppretter UV-indusert LC-migrering fra overhuden til hud-drenerende lymfeknuter: en av de viktigste mobile event i UV-immunsuppresjon (39)., Toleranse-indusert av LC er mediert av utslipp av immundempende cytokin som IL-10, og ved forstyrrelser med modning og induksjon av regulatoriske T-celler (Tregs) (40). Dessuten nylig en interessant link har blitt rapportert blant LC, Tregs og vitamin D3. Ja, det har vært vist at en kortsiktig 1 uke aktuell pre-behandling med 1,25-dihydroxyvitamin D analog, calcipotriol, redusert PLE symptomer etter påfølgende eksperimentelle photoprovocation (41)., I tillegg, i en murin studie 1,25-dihydroxyvitamin D viste sammenlignbare immunsuppressive effekter som UV (42). En annen interessant krysstale har blitt markert mellom LCs og mastceller. I tillegg til sine anerkjent rolle i atopi, dermal mastceller er også ansvarlig for å beskytte huden mot UVB-indusert betennelser, fremme UV immunsuppresjon (40). Studier på mennesker har vist at etter akutt og kronisk UVR eksponering, dermal mastceller antallet øker, sammen med utgivelsen av IL-10., Totalt sett disse dataene antyder en potensiell rolle for mastceller i PLE, og i mekanismen av photohardening. I samsvar med dette, Wolf et al. har rapportert for første gang, som photohardening signifikant øker mast celle tetthet i papillar dermis av PLE pasienter (40). Oppsummering, photohardening fungerer i PLE ved å gjenopprette normal UV-immune undertrykkende vei, som involverer flere celletyper. Den tredje linje behandling for PLE inkluderer bruk av systemisk immundempende legemidler, som for eksempel azatioprin og ciklosporin., Det er imidlertid bare sporadiske tilfeller av pasienter vellykket behandlet, er rapportert i litteraturen (43, 44). Videre, hydroksyklorokin, omega-3 fettsyrer, og beta-karoten har vært foreslått som behandling, men ytterligere dobbelt-blind, randomisert kontrollert forsøk for å virkelig vurdere sin klinisk effekt er nødvendig.
Konklusjon
Siden høy prevalens og økende forekomsten av PLE, knyttet til ubehag og livsstil restriksjoner, fremtidige studier er nødvendig for å finne roman terapeutisk og/eller forebyggende strategier., Valg av riktig PLE behandlingen krever god kunnskap om de enkelte kliniske forløpet av sykdommen sammen med muligheten til å utføre phototest. Noen nye aspekter i mulig aktivering og markedsføring av den inflammatoriske prosessen som har vært fremhevet.,
den nåværende tilstand av kunnskap, til tross for identifisering av noen avgjørende mobil regulering involvert på restaurering av immunforsvaret toleranse, det er vanskelig å trekke klare konklusjoner om effekten av ulike potensielle behandlinger i PLE, på grunn av mangel på adekvate studier og vanskelig å vurdere utfallet tiltak. Den kliniske score for å vurdere PLE alvorlighetsgrad (PLESI) (45) er et instrument knapt brukt og er i hovedsak begrenset til forskningsformål., Den dypere studie av den underliggende pathogenetic mekanismer lidelse vil tillate en mer målrettet behandling tilnærming.
Forfatter Bidrag
SL anslått manus, valgte materiale til papir, skrev den første utkast og korrigert følgende utkast av manus. AR var engasjert i skriving av manus, støtter nye ideer til innhold og stil.,
interessekonflikt Uttalelse
forfatterne erklærer at forskningen ble utført i fravær av kommersielle eller finansielle forhold som kan oppfattes som en potensiell interessekonflikt.
Supplerende Materiale
Figur S1. Samspill mellom medfødte og adaptive immunforsvaret i en kontekst av apoptosis svikt i overhuden. (Grønt symbol) Psoriasin: rikelig uttrykk i spinous og granulære lag av PLE hud. (Blå symboler) RNase7: hovedsakelig uttrykt i keratinocytes av stratum granulosum og stratum corneum av PLE lesjoner., (Gul symbol) LL-37 var dypt uttrykt i og rundt blodårene og kjertler i PLE. (Fiolett celle symbol) Apoptotic keratinocytes med ineffektive klaring.,hic light eruption; ACD, Allergic contact dermatitis; DTHR, Delayed type hypersensitivity reaction; UVR, Ultraviolet radiation; C1s, Complement 1s subunit; SCARB1, Scavenger receptor B1; FN1, Fibronectin; IGSF3, Immunoglobulin superfamily member 3; CASP1, Caspase-1; PON2, Paraoxonase 2; MED, Minimal Erythema Dose; DCs, Dendritic cells; LCs, Langerhans cells; TLR, Toll like receptor; AMPs, Antimicrobial peptides; SPF, Sun protection factor; PUVA, Psoralen and UVA therapy; NB-UVB, Narrowband; BB-UVB, Broadband UVB; MPD, Minimum phototoxic dose; Tregs, Regulatory T cells; PL, Polypodiumleucotomos.,
2. McGregor JM, Grabczynska S, Vaughan R, Hawk JL, Lewis CM. Genetic modelling of abnormal photosensitivity in families with polymorphic light eruption and actinic prurigo. J Invest Dermatol. (2000) 115:471–6. doi: 10.1046/j.1523-1747.2000.00080.x
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Lembo S, Hawk JLM, Murphy GM, Kaneko K, Young AR, McGregor JM, et al., Aberrant gene expression with deficient apoptotic keratinocyte clearance may predispose to polymorphic light eruption. Br J Dermatol. (2017) 177:1450–3. doi: 10.1111/bjd.15200
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Savill J, Fadok V. Corpse clearance defines the meaning of cell death. Nature (2000) 407:784–8. doi: 10.,1038/35037722
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Kuhn A, Herrmann M, Kleber S, Beckmann-Welle M, Fehsel K, Martin-Villalba A, et al. Accumulation of apoptotic cells in the epidermis of patients with cutaneous lupus erythematosus after ultraviolet irradiation. Arthritis Rheum. (2006) 54:939–50. doi: 10.1002/art.21658
PubMed Abstract | CrossRef Full Text | Google Scholar
6., Savill J, Dransfield I, Gregory C, Haslett C. A blast from the past: clearance of apoptotic cells regulates immune responses. Nat RevImmunol. (2002) 2:965–75. doi: 10.1038/nri957
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Albert ML, Sauter B, Bhardwaj N. Dendritic cells acquire antigen from apoptotic cells and induce class I-restricted CTLs. Nature (1998) 392:86–9. doi: 10.,1038/32183
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Koulu LM, Laihia JK, Peltoniemi HH, Jansén CT. UV-induced tolerance to a contact allergen is impaired in polymorphic light eruption. J Invest Dermatol. (2010) 130:2578–82. doi: 10.1038/jid.2010.181
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Epstein JH. Polymorphous light eruption. J Am Acad Dermatol. (1980) 3:329–43.,
PubMed Abstract | Google Scholar
12. Mattii M, Ayala F, Balato N, Filotico R, Lembo S, Schiattarella M, et al. The balance between pro- and anti-inflammatory cytokines is crucial in human allergic contact dermatitis pathogenesis: the role of IL-1 family members. Exp Dermatol. (2013) 22:813–9. doi: 10.1111/exd.12272
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Dinarello CA., Interleukin-1 i patogenesen og behandling av inflammatoriske sykdommer. Blodet (2011) 117:3720-32. doi: 10.1182/blod-2010-07-273417
PubMed Abstrakt | CrossRef Full Tekst | Google Scholar
16. Lembo S, Caiazzo G, Balato N, Monfrecola G, Patra V, Ulv P, et al. Polymorf lys utbrudd og IL-1 familiemedlemmer: noen forskjell med allergisk kontakteksem? Photochem Photobiol Sci. (2017) 16:1471-9. doi: 10.,1039/c7pp00142h
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Balato A, Schiattarella M, Lembo S, Mattii M, Prevete N, Balato N, et al. Interleukin-1 family members are enhanced in psoriasis and suppressed by vitamin D and retinoic acid. Arch Dermatol Res. (2013) 305:255–62. doi: 10.1007/s00403-013-1327-8
PubMed Abstract | CrossRef Full Text | Google Scholar
19., Borkowski AW, Kuo IH, Bernard JJ, Yoshida T, Williams MR, Hang NJ. Toll-like receptor 3 aktivering er nødvendig for normal hud barrier repair følgende UV-skader. J. Investere Dermatol. (2015) 135:569-78. doi: 10.1038/jid.2014.354
PubMed Abstrakt | CrossRef Full Tekst | Google Scholar
20. Li N, Yamasaki K, Saito R, Fukushi-Takahashi S, Shimada-Omori R, Asano M, et al. Alarmin funksjon av cathelicidin antimikrobielle peptid LL37 gjennom IL-36γ induksjon i human epidermal keratinocytes. J Immunol., (2014) 193:5140–8. doi: 10.4049/jimmunol.1302574
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Patra V, Wolf P. Microbial elements as the initial triggers in the pathogenesis of polymorphic light eruption? Exp Dermatol. (2016) 25:999–1001. doi: 10.1111/exd.13162
PubMed Abstract | CrossRef Full Text | Google Scholar
22., Gläser R, Navid F, Schuller W, Jantschitsch C, Hardere J, Schröder JM, et al. UV-B-stråling induserer uttrykk for antimikrobielle peptider i menneskelig keratinocytes in vitro og in vivo. J Allergy Clin Immunol. (2009) 123:1117-23. doi: 10.1016/j.jaci.2009.01.043
PubMed Abstrakt | CrossRef Full Tekst | Google Scholar
23. Patra V, Mayer G, Gruber-Wackernagel En, Horn M, Lembo S, Ulv S., Unik profil av antimikrobielle peptid uttrykk i polymorf lys utbrudd lesjoner i forhold til sunn hud, atopisk eksem og psoriasis. Photodermatol Photoimmunol Photomed. (2018) 34:137-44. doi: 10.1111/phpp.12355
PubMed Abstrakt | CrossRef Full Tekst | Google Scholar
25. Schweintzger NA, Gruber-Wackernagel En, Shirsath N, Quehenberger F, Obermayer-Pietsch B, Ulv S. Påvirkning av årstidene på vitamin D-nivåer og regulatoriske T-celler hos pasienter med polymorf lys utbrudd., Photochem Photobiol Sci. (2016) 15:440–6. doi: 10.1039/c5pp00398a
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Proby C, Baker C, Morton O, Hawk JLM. New broad spectrum sunscreen for polymorphic light eruption. Lancet (1993) 341:1347–8.
PubMed Abstract | Google Scholar
28. Allas S, Lui H, Moyal D, Bissonnette R., Sammenligning av evnen til 2 solkremer for å beskytte mot polymorphous lys utbrudd forårsaket av UV-A/UV-B metallhalogen lyskilde. Arch Dermatol. (1999) 135:1421-2.
PubMed Abstrakt | Google Scholar
29. Ortel B, Wechdorn D, Tanew En, Honigsmann H. Effekten av nikotinamid på phototest reaksjon i polymorphous lighteruption. Br J Dermatol. (1988) 118:669-73.
PubMed Abstrakt | Google Scholar
30., Caccialanza M, Percivalle S, Piccinno R, Brambilla R. Photoprotective activity of oral Polypodiumleucotomos extract in 25 patients with idiopathic photodermatoses. Photodermatol Photoimmunol Photomed. (2007) 23:46–7. doi: 10.1111/j.1600-0781.2007.00274.x
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Tanew A, Radakovic S, Gonzalez S, Venturini M, Calzavara-Pinton P. Oral administration of a hydrophilic extract of Polypodiumleucotomos for the prevention of polymorphic light eruption., J Am Acad Dermatol. (2012) 66:58–62. doi: 10.1016/j.jaad.2010.09.773
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Van Praag MCG Boom, BW, Vermeer BJ. Diagnosis and treatment of polymorphous light eruption. Int J Dermatol. (1994) 33:233–9.
Google Scholar
34. Ling TC, Clayton TH, Crawley J, Exton LS, Goulden V, Ibbotson S, et al., British association of hudleger og britiske photodermatology gruppens retningslinjer for sikker og effektiv bruk av psoralen-ultrafiolett A terapi 2015. Br J Dermatol. (2016) 174:24-55. doi: 10.1111/bjd.14317
PubMed Abstrakt | CrossRef Full Tekst | Google Scholar
36. Mannen jeg, Dawe RS, J. Ferguson Kunstig herding for polymorf lys utbrudd: praktisk poeng fra ti års erfaring. Photodermatol Photoimmunol Photomed. (1999) 15:3-4.,
PubMed Abstract | Google Scholar
37. Mastalier U, Kerl H, Wolf P. Clinical laboratory, phototest and phototherapy findings in polymorphic light eruptions: a retrospective study of 133 patients. Eur J Dermatol. (1998) 8:554–9.
PubMed Abstract | Google Scholar
38. Krutmann J, Morita A. Mechanisms of ultraviolet (UV) B and UVA phototherapy. J Invest Dermatol Symp Proc. (1999) 4:70–2.,
PubMed Abstract | Google Scholar
39. Janssens AS, Pavel S, Out-Luiting JJ, Willemze R, de Gruijl FR. Normalized ultraviolet (UV) induction of Langerhans cell depletion and neutrophil infiltrates after artificial UVB hardening of patients with polymorphic light eruption. Br J Dermatol. (2005) 152:1268–74. doi: 10.1111/j.1365-2133.2005.06690.x
PubMed Abstract | CrossRef Full Text | Google Scholar
40., Ulv S, Gruber-Wackernagel En, Bambach jeg, Schmidbauer U, Mayer G, Absenger M, et al. Photohardening av polymorfe lys utbrudd pasienter reduseres baseline epidermal Langerhans celle tetthet samtidig øke mast celle tall i papillar dermis. Exp Dermatol. (2014) 23:428-30. doi: 10.1111/exd.12427
PubMed Abstrakt | CrossRef Full Tekst | Google Scholar
42. Schwarz En, Navid F, Sparwasser T, Clausen VÆRE, Schwarz T., 1,25-dihydroxyvitamin D exerts similar immunosuppressive effects as UVR but is dispensable for local UVR-induced immunosuppression. J Invest Dermatol. (2012) 132, 2762–9. doi: 10.1038/jid.2012.238
PubMed Abstract | CrossRef Full Text | Google Scholar
43. Norris PG, Hawk JL. Successful treatment of severe polymorphous light eruption with azathioprine. Arch Dermatol. (1989) 125:1377–9.
PubMed Abstract | Google Scholar