원자와 빛 에너지
연구의 원자고 그들의 특성이 겹치는 여러 differentsciences. 화학자,물리학 자 및 천문학 자들은 모두”더 큰 그림”을보기 위해 우주의 많은 부분이 기능하는 심리적 규모를 이해해야합니다.,
안에 원자
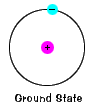 |
상태의 전자,에너지 수준 itnormally 차지하고,국가의 가장 낮은 에너지를 전자현. |
| 있다 또한 최대한 에너지는 각각 전자 canhave 고,아직도 부분은 그것의 원자입니다. 그 에너지 저쪽에,electronis 는 더 이상 원자의 핵에 묶이지 않으며 이온화 된 것으로 간주됩니다., | 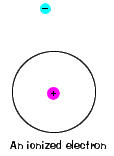 |
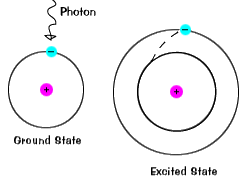 |
경우 전자는 일시적으로 차지한 에너지 상태보다 큰 itsground 상태에서 흥분된 상태입니다.전자 될 수 있는 흥분하는 경우 그것은 주어진 여분의 에너지는 경우와 같이 itabsorbs 광자,또는 패킷의 빛과 충돌하거나 근처 원자 또는 입자. |
빛 에너지
이 페이지의 그림은 물론 실제 원자의 단순화 된 버전입니다. 실제 원자,심지어 상대적으로 간단한 사람처럼 수소,많은 다른 orbitals,그리고 그렇게 많은 가능한 energieswith 다른 최초 및 최종 states., 원자가 흥분 상태에있을 때,전자는 한 번에 모든 방법을 접지 상태로 떨어 뜨리거나 중간 수준에서 도중에 멈출 수 있습니다.
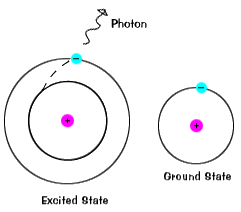 |
전자는 유지하지 않습에서 흥분하다 아주 오랫동안-그들은 soonreturn 그들의 지상국을 방출,광자와 sameenergy 하나로 흡수되었습니다., |
인 형태의 원자
전환 사이에 각종 궤도 독특하고 각 요소에 대해하기 때문에 theenergy 수준은 유일하게 결정에 의해 양성자 및 중성자에 thenucleus. 우리는 서로 다른 원소가 서로 다른 수를 가지고 있음을 알고 있습니다.핵에서 단백질과 중성자. 질 때는 전자의 특정한 원자로 돌아 낮은 orbitalsfrom 흥분한국,광자들을 방출하는 에너지는 arecharacteristic 의하는 종류의 원자입니다., 이것은 eachelement 에 고유 한 지문을 제공하여 가스 용기 또는 심지어 별에 존재하는 요소를 식별 할 수있게합니다.
우리는 우리 공구를 사용할 수 있는 원소의 주기율표를 파악 exactlyhow 많은 양성자,그리고 따라서 전자,원자니다. 우선,우리는원자가 중성 전하를 갖기 위해서는 같은 수의 전자와 전자를 가져야합니다. 원자가 전자를 잃거나 얻으면온화되거나 충전된다. 주기율표는 우리에게 원자 번호를 줄 것입니다.원소. 원자 번호는 원자가 얼마나 많은 양성자를 우리에게 알려줍니다., 예를 들어,수소 원자의 숫자 중 하나는 hasone 양성자,그리고 따라서 하나의 전자 전하고 실제로는 더 중성자.
학생의 경우
원자의 이전 설명을 기반으로 수소 원자의 amodel 을 그립니다. 원자의”표준”모델이 알려져 있습니다.보어 모델.
다른 형태의 화학적 요소만 다른 수를 중성자의 핵이라고는 동위 원소. 대부분의 원소는하나의 자연 발생 동위 원소., 더 많은 동위 원소가있었습니다.원자로와 과학 실험실에서 생산되었습니다. 동위 원소는 일반적으로 매우 안정적이지 않으며,보다 안정한 것이 형성 될 때까지 방사성 붕괴를 겪는 경향이있다. 당신은 elementuranium 에 익숙 할 수 있습니다-그것은 몇 가지 불안정한 동위 원소를 가지고 있으며,U-235 는 가장 많이 알려져 있습니다. 235 는이 형태의 우라늄이 235 개의 중성자를 가지고 있음을 의미합니다.양성자가 결합되었다. 우리가 우라늄의 원자 번호를 찾아보고 235 에서 빼면 동위 원소가 가지고있는 중성자의 수를 계산할 수 있습니다.,
여기에 또 다른 예를 들어-탄소 일반적으로 발생하는 형태의 C-12 일(탄소 12),그것은,6 개의 양성자 및 6 개의 중성자,그 동위 원소는 C-13,6protons 및 7 개의 중성자.
에 대한 학생
를 사용하여 정기적인 테이블의 요소의 이름은 아래의 그 밖으로 얼마나 많은 양성자,중성자와 전자들.실리콘-28,마그네슘-24,황-32,산소-16 및 헬륨-4 의 원자 모델을 그립니다.,
에 대한 학생
텍스트를 사용하여 정의는 다음 약관:에너지 레벨,흡수,발광,상태,바닥 상태,이온화,원자,요소,원자량,원자 번호,동위 원소.
Optional 에 참고 양자의 기계적 특성에 원자면 원자는 단점이 위에서 설명할 수 있는 좋은 배의 구조에 대한 원자로,그것은 가장 정확하지 않는 방법 tomodel 니다., 지만 각각의 궤도가 있는 정확한 에너지,theelectron 제로 구상되고 지저분에서”전자 클라우드”주변의 핵. 그것은 일반적인 말의 평균 거리 thecloud 으로 반경의 전자 궤도.그래서 그냥 기억을 하겠어”궤도”및”궤도”이지만 우리가 arenow 를 사용하여 그들이 설명하지 않 평 궤도기,하지만 aregion 는 전자는 확률이다. 전자는 핵과 전자 사이의 전기 인력에 의해 핵 근처에 유지됩니다.,9 개의 행성이 은하계를 돌아 다니는 대신 태양 근처에 머무르는 것과 같은 방식으로 거기에 보관되었습니다. 모든 행성의 궤도가 같은 평면에 존재하는 태양계와는 달리,전자 궤도는 더 입체적입니다. 각각원자의 에너지 수준은 다른 모양을 가지고 있습니다. 그 궤도에서 전자의 위치 확률을 알려주는 수학 방정식이 있습니다. 우리가 이미 보어 모델을 그린 수소 원자.,
이 섹션의 텍스트와 이미지는 Dave Slaven 의 페이지 Onthe Atom(아래 참조 참조)에서 수정되었습니다.나는 이것을 할 수 없다. 답글 남기기 |

