Sostituzione nucleofila del gruppo idrossilico
Il comportamento chimico degli alogenuri alchilici può essere utilizzato come riferimento nella scoperta di reazioni analoghe di sostituzione ed eliminazione di alcoli. La principale differenza, ovviamente, è un cambiamento nell’anione uscente dall’alogenuro all’idrossido. Poiché l’ossigeno è leggermente più elettronegativo del cloro (3,5 contro 2,8 sulla scala di Pauling), il legame C-O dovrebbe essere più polare di un legame C-Cl., Inoltre, una misura indipendente delle caratteristiche elettrofile degli atomi di carbonio dai loro spostamenti chimici NMR (sia protoni 13C che alfa) indica che i sostituenti di ossigeno e cloro esercitano una simile influenza di ritiro degli elettroni quando legati agli atomi di carbonio ibridati sp3. Nonostante questa promettente evidenza di fondo, gli alcoli non subiscono le stesse reazioni SN2 comunemente osservate con alogenuri alchilici. Ad esempio, la reazione rapida SN2 di 1-bromobutano con cianuro di sodio, mostrata sotto, non ha paralleli quando 1-butanolo viene trattato con cianuro di sodio., Infatti, l’alcol etilico è spesso usato come solvente per reazioni di sostituzione alogenuri alchilici come questa.
CH3CH2CH2CH2–Br + Na(+) CN(–)  CH3CH2CH2CH2–NC + Na(+) Br(–)
CH3CH2CH2CH2–NC + Na(+) Br(–)
CH3CH2CH2CH2–OH + Na(+) CN(–)  Nessuna risposta
Nessuna risposta
Il fattore chiave qui è la stabilità dell’lasciando anione (bromuro vs idrossido)., HBr è un acido molto più forte dell’acqua (di oltre 18 ordini di grandezza) e questa differenza si riflette nelle reazioni che generano le rispettive basi coniugate. La base più debole, il bromuro, è più stabile e il suo rilascio in una reazione di sostituzione o eliminazione è molto più favorevole di quella dello hydroxide idrossido, una base più forte e meno stabile.
Un chiaro passo verso il miglioramento della reattività degli alcoli nelle reazioni SN2 sarebbe quello di modificare il gruppo funzionale –OH in modo da migliorare la sua stabilità come anione uscente., Una di queste modifiche consiste nel condurre la reazione di sostituzione in un acido forte, convertendo –OH in –OH2(+). Poiché lo hyd idronio (H3O(+)) è un acido molto più forte dell’acqua, la sua base coniugata (H2O) è un gruppo di partenza migliore dello hydroxide idrossido. L’unico problema con questa strategia è che molti nucleofili, incluso il cianuro, sono disattivati dalla protonazione in acidi forti, rimuovendo efficacemente il co-reagente nucleofilo richiesto per la sostituzione., Gli acidi forti HCl, HBr e HI non sono soggetti a questa difficoltà perché le loro basi coniugate sono buoni nucleofili e sono basi anche più deboli degli alcoli. Le seguenti equazioni illustrano alcune reazioni di sostituzione di alcoli che possono essere influenzati da questi acidi. Come con alogenuri alchilici, la sostituzione nucleofila di 1º-alcoli procede con un meccanismo SN2, mentre 3º-alcoli reagiscono con un meccanismo SN1. Le reazioni di 2º-alcoli possono verificarsi da entrambi i meccanismi e spesso producono alcuni prodotti riorganizzati., I numeri tra parentesi accanto alle formule di acidi minerali rappresentano la percentuale in peso di una soluzione acquosa concentrata, la forma in cui questi acidi sono normalmente utilizzati.
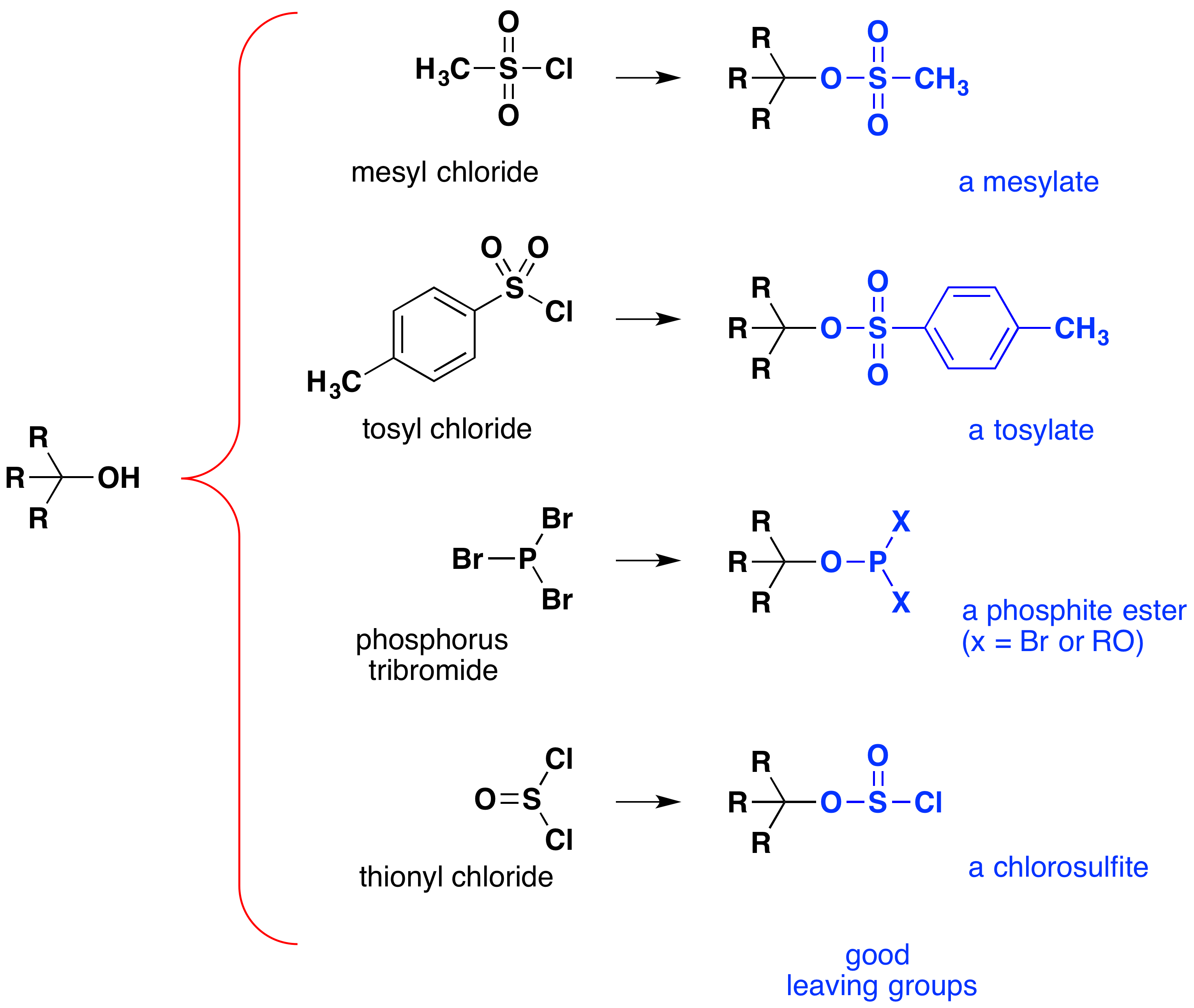
Sebbene queste reazioni siano talvolta definite “catalizzate da acido”, ciò non è strettamente corretto. Nella trasformazione complessiva, un acido HX forte viene convertito in acqua, un acido molto debole, quindi è necessaria almeno una quantità stechiometrica di HX per una conversione completa dell’alcol in alogenuro alchilico., La necessità di utilizzare quantità equivalenti di acidi molto forti in questa reazione limita la sua utilità agli alcoli semplici del tipo mostrato sopra. Gli alcoli con gruppi sensibili agli acidi non tollerano, ovviamente, tale trattamento. Tuttavia, l’idea di modificare il gruppo funzionale-OH per migliorare la sua stabilità come anione uscente può essere perseguita in altre direzioni. Il diagramma seguente mostra alcune modifiche che si sono dimostrate efficaci. In ogni caso il gruppo idrossile viene convertito in un estere di un acido forte. I primi due esempi mostrano gli esteri di solfonato descritti in precedenza., Il terzo e il quarto esempio mostrano la formazione di un estere fosfito (X rappresenta i restanti bromi o sostituenti alcolici aggiuntivi) e un estere clorosolfito, rispettivamente. Tutti questi gruppi di partenza (di colore blu) hanno acidi coniugati che sono molto più forti dell’acqua (da 13 a 16 potenze di dieci); quindi, l’anione di partenza è corrispondentemente più stabile dello hydroxide idrossido. I composti di mesilato e tosilato sono particolarmente utili perché possono essere utilizzati in reazioni di sostituzione con un’ampia varietà di nucleofili., Gli intermedi prodotti nelle reazioni di alcoli con tribromuro di fosforo e cloruro di tionile (ultimi due esempi) sono raramente isolati e queste reazioni continuano a produrre prodotti di bromuro di alchile e cloruro.
L’importanza degli intermedi di estere solfonato nelle reazioni di sostituzione nucleofila generale degli alcoli può essere illustrata dalla seguente conversione di 1-butanolo in pentanenitrile (cianuro di butile), una reazione che non si verifica con l’alcol da solo., Gli alogenuri di fosforo e tionile, d’altra parte, agiscono solo per convertire gli alcoli nei corrispondenti alogenuri alchilici.,
| CH3CH2CH2CH2–OH + CH3SO2Cl | pyridine
|
CH3CH2CH2CH2–OSO2CH3 | Na(+) CN(–)
|
CH3CH2CH2CH2–CN + CH3SO2O(–) Na(+) |
Some examples of alcohol substitution reactions using this approach to activating the hydroxyl group are shown in the following diagram., I primi due casi servono a rafforzare il fatto che i derivati dell’estere solfonato degli alcoli possono sostituire gli alogenuri alchilici in una varietà di reazioni SN2. I prossimi due casi dimostrano l’uso del tribromuro di fosforo nella conversione di alcoli in bromuri. Questo reagente può essere utilizzato senza aggiunta di base (ad esempio piridina) perché il prodotto acido fosforoso è un acido più debole dell’HBr. Il tribromuro di fosforo è meglio utilizzato con 1º-alcoli perché 2º-alcoli spesso producono sottoprodotti di riarrangiamento derivanti da reazioni SN1 concorrenti., Si noti che l’ossigeno dell’etere nella reazione 4 non è influenzato da questo reagente, mentre la sintesi alternativa utilizzando HBR concentrato fende gli eteri. Il tricloruro di fosforo (PCl3) converte gli alcoli in cloruri alchilici in modo simile, ma il cloruro di tionile è solitamente preferito per questa trasformazione perché i prodotti inorganici sono gas (SO2 & HCl). Il triioduro di fosforo non è stabile ma può essere generato in situ da una miscela di fosforo rosso e iodio e agisce per convertire gli alcoli in ioduri alchilici., L’ultimo esempio mostra la reazione del cloruro di tionile con un alcol chirale 2º. La presenza di una base organica come la piridina è importante perché fornisce una concentrazione sostanziale di chloride cloruro necessaria per la reazione SN2 finale dell’intermedio clorosufito., In assenza di una base, i clorosufiti si decompongono al riscaldamento per produrre il cloruro alchilico previsto con ritenzione della configurazione
Gli alcoli terziari non sono comunemente usati per reazioni di sostituzione del tipo discusso qui perché i percorsi di reazione SN1 ed E1 sono dominanti e sono difficili da controllare.

L’importanza degli esteri solfonati come intermedi in molte reazioni di sostituzione non può essere sopravvalutata., Una prova rigorosa dell’inversione configurazionale che si verifica nel sito di sostituzione nelle reazioni SN2 fa uso di tali reazioni. Un esempio di tale prova viene visualizzato di seguito. Le abbreviazioni per i derivati sulfonilici più comunemente usati sono riportate nella seguente tabella.
| Sulfonyl Gruppo | CH3SO2– | CH3C6H4SO2– | BrC6H4SO2– | CF3SO2– |
|---|---|---|---|---|
| Nome & Abbrev., | Mesyl o Ms | Tosilato o Ts | Brosyl o Bs | Trifyl o Tf |
Inversione di Prova

Per una discussione più completa di idrossile reazioni di sostituzione e una descrizione di altri metodi selettivi per questa trasformazione, fare Clic Qui.
Contributori
- William Reusch, Professore emerito (Michigan State U.,), Virtual Textbook of Organic Chemistry