La fibrillazione atriale non valvolare (NVAF) è l’aritmia più frequente in Spagna. L’incidenza è strettamente correlata all’età, con una prevalenza vicina al 25% nei pazienti di età superiore agli 80 anni.1 Tra i molti processi associati a NVAF, l’incidente cerebrovascolare di origine cardioembolica è probabilmente la complicanza più grave in quanto porta ad alti tassi di disabilità e mortalità.,2 Un altro problema associato alla fibrillazione atriale è la necessità di una terapia anticoagulante orale (OAC) per prevenire eventi cardioembolici. Questa necessità cresce con l’età avanzata in quanto il rischio di un evento è ancora maggiore.1 Inoltre, il rischio di complicanze associate alla terapia anticoagulante, in particolare di sanguinamento, aumenta anche in questi pazienti.3 Attualmente, l’occlusione dell’appendice atriale sinistra percutanea (LAA) è un’alternativa per i pazienti con NVAF e controindicazioni al trattamento OAC.,4,5
TERAPIA ANTICOAGULANTE ORALE: EFFICACIA E LIMITAZIONI
La terapia anticoagulante con antagonisti della vitamina K è considerata il trattamento standard per NVAF. I principali problemi con questi farmaci sono l’aumento del rischio di sanguinamento, la necessità di controlli regolari, l’interazione con il cibo o altri farmaci e l’instabilità dell’azione del farmaco in alcuni casi. Si stima che tra il 30% e il 50% dei pazienti indicati per OAC non li ricevano.6 Con l’introduzione di nuovi anticoagulanti come dabigatran, 7 apixaban, 8 e rivaroxaban, 9 la gestione di questi pazienti potrebbe cambiare., In ogni caso, e nonostante il loro profilo d’azione più stabile e più sicuro, il rischio di sanguinamento, con un tasso annuo compreso tra il 2,1% e il 3,6%, continua ad essere il principale tallone d’Achille di questi nuovi agenti (Tabella). Infatti, registri più recenti indicano che l’incidenza di eventi cardioembolici ed emorragia secondaria a dabigatran potrebbe essere simile a quelli di warfarin.10 Nonostante l’introduzione di nuovi agenti anticoagulanti, la percentuale di pazienti indicati per OAC ma non trattati rimane intorno al 40%.,11 Di fronte alla scarsa aderenza alla terapia e al persistente rischio di emorragia, la necessità di alternative alla terapia anticoagulante è diventata una priorità per questi pazienti.
APPENDICE ATRIALE SINISTRA: FUNZIONE, ANATOMIA E INDICAZIONI PER L’OCCLUSIONE
Il LAA è un residuo embriologico e la sua funzione principale è quella di controllare il volume del sangue. Si trova molto vicino all’arteria circonflessa sinistra, confinante al livello superiore con la vena polmonare superiore sinistra e al livello inferiore con la valvola mitrale., La morfologia della LAA è straordinariamente eterogenea da un paziente all’altro e spesso c’è più di un lobo. Nel ritmo sinusale, il LAA è una struttura contrattile che svuota il suo contenuto ad ogni battito cardiaco. Nella fibrillazione atriale, il LAA perde la sua capacità contrattile e si dilata, portando ad un rallentamento del flusso sanguigno, con il conseguente aumento del rischio di trombosi. Negli studi di patologia di pazienti con NVAF, il 91% dei trombi situati nell’atrio sinistro si trovano nel LAA., Ciò ha portato alla convinzione che l’occlusione percutanea di LAA potrebbe essere una strategia efficace per prevenire il rischio cardioembolico nei pazienti con NVAF.
L’occlusione percutanea della LAA è ancora nella sua fase iniziale e devono ancora passare alcuni anni prima di poter ottenere una visione più affidabile del suo ruolo nei pazienti con NVAF. Anche se, in futuro, potrebbe costituire una vera alternativa per i pazienti senza controindicazioni per OAC, attualmente il suo uso dovrebbe essere riservato a quei pazienti con controindicazioni alla terapia anticoagulante, come raccomandato nelle linee guida europee (indicazione IIb).,5 In effetti, la maggior parte delle procedure in pazienti che ricevono terapia anticoagulante sono riferite dal servizio di neurologia dopo un episodio di sanguinamento intracranico, o dalla gastroenterologia dopo l’osservazione di sanguinamento digestivo ricorrente senza causa curabile. La mancanza di valide alternative all’OAC per prevenire il rischio cardioembolico, che è generalmente elevato in quanto si tratta di pazienti in genere più anziani con patologie multiple, rende l’occlusione LAA un’opzione altamente attraente per questi pazienti., Labile rapporto normalizzato internazionale o la comparsa di un evento cardioembolico nonostante il trattamento con OAC e un adeguato rapporto normalizzato internazionale sono altri contesti in cui l’occlusione percutanea di LAA potrebbe essere giustificata. In ogni caso, sono necessarie decisioni multidisciplinari e individualizzate per valutare sia il rischio cardioembolico che emorragico e altri fattori essenziali come l’efficacia del trattamento, la fragilità del paziente o l’aderenza al trattamento, specialmente con OAC.
DISPOSITIVI DI OCCLUSIONE DELL’APPENDICE ATRIALE SINISTRA PERCUTANEA
Il dispositivo PLAATO™ è stato il primo occluder LAA percutaneo (Fig. 1)., Nonostante i buoni risultati preliminari in termini di efficacia e sicurezza, il programma di sviluppo è stato sospeso e il dispositivo è scomparso dal mercato.
Attualmente, i due dispositivi più frequentemente utilizzati in tutto il mondo sono il sistema Watchman™ (Boston Scientific; Boston, Massachusetts, Stati Uniti) e l’Amplatzer ™ Cardiac Plug (ACP) (St. Jude Medical; Minneapolis, Minnesota, Stati Uniti) (Fig. 1). Come il sistema PLAATO™, entrambi sono impiantati tramite via transettale utilizzando l’accesso alla vena femorale., Entrambe le protesi sono altamente flessibili e hanno un sistema di guide stabilizzanti che si ancorano alla parete della LAA e quindi evitano l’embolizzazione. La differenza principale tra i due dispositivi, tuttavia, è nella loro forma. Il sistema Watchman™ viene impiantato a 10 mm dall’ostium LAA, e quindi non lo copre; l’ACP contiene un lobo che viene impiantato a 10-15 mm dall’ostium e un disco che copre completamente l’ostium LAA (Fig. 2). Un ACP di seconda generazione chiamato Amplatzer ™ Amulet™ è recentemente apparso sul mercato. Il dispositivo Amulet™ (Fig., 1) è anche a forma di lobo e ha un disco come l’ACP, ma ha modifiche che facilitano la preparazione e l’impianto del dispositivo e, allo stesso tempo, riducono al minimo il rischio di embolizzazione e trombosi.
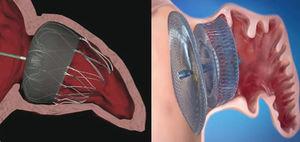
Posizione dei dispositivi Watchman™ e Amplatzer™ Cardiac Plug dopo l’impianto nell’appendice atriale sinistra., Dispositivo Watchman ™ impiantato a 10 mm dall’ostio dell’appendice atriale sinistra (sinistra) e dispositivo Amplatzer™ Cardiac Plug con il lobo impiantato a 10 mm dall’ostio e il disco che copre l’ingresso dell’appendice atriale sinistra (destra).
Numerosi registri attestano l’efficacia e la sicurezza del sistema Watchman™ e dell’ACP, ma entrambi richiedono una curva di apprendimento dell’impianto non trascurabile., Lo studio PROTECT AF, 12 l’unico studio randomizzato per confrontare warfarin con LAA occlusione (Watchman™) in pazienti con NVAF, ha dimostrato che l’occlusione LAA non è meno efficace di warfarin per quanto riguarda l’obiettivo primario (accidente cerebrovascolare combinato, embolia sistemica e morte cardiovascolare o inspiegabile), ma ha mostrato un tasso preoccupante di eventi periprocedurali, con incidenza del 4,4% di versamento pericardico grave., Questo problema iniziale è stato attribuito alla curva di apprendimento dell’operatore: con l’esperienza dell’operatore, il tasso di complicanze è diminuito e la percentuale di impianti riusciti è migliorata in modo significativo. Attualmente (per entrambi i dispositivi) più del 95% degli impianti sono generalmente riusciti e il tasso di versamento pericardico grave è
CONSIDERAZIONI TECNICHE
La tecnica percutanea di occlusione LAA richiede un team con esperienza in malattie congenite/strutturali., Sebbene alcuni gruppi utilizzino solo l’ecocardiografia intracardiaca, o anche il controllo angiografico, per guidare la procedura ed evitare l’intubazione del paziente, la maggior parte dei centri utilizza l’ecocardiografia transesofagea (TEE) in anestesia generale. Strutturalmente, il LAA ha pareti molto fini e una morfologia eterogenea che può nascondere le microtrombosi dal TEE. L’esperienza dell’operatore è essenziale per ridurre al minimo la manipolazione all’interno del LAA e quindi ridurre il rischio di perforazione ed embolia periprocedurale., Due dei fattori più importanti che minimizzano la manipolazione nel LAA sono i seguenti: a) una puntura transsettale posteriore bassa che facilita un approccio frontale al LAA e b) uno studio dettagliato del LAA, se possibile con TEE e angiografia, al fine di stabilire la morfologia del LAA e ottenere misure accurate che facilitano la selezione delle dimensioni dell’occlusore. Si raccomanda di effettuare misurazioni a volume ematico normale poiché le dimensioni della LAA possono variare in modo significativo in funzione del livello di idratazione del paziente., Durante la procedura, i pazienti tendono a disidratarsi; pertanto, si raccomanda di determinare la pressione dell’atrio sinistro e somministrare liquido per mantenere>10 mmHg di pressione prima di eseguire le misurazioni.
Questa è una procedura relativamente nuova e, anche se TEE è lo standard di imaging, la modalità di imaging ideale rimane sconosciuta. La morfologia della LAA è ovale nell ‘ 80% dei pazienti, quindi i diametri di solito variano a causa degli assi corti e lunghi. Questa differenza può passare inosservata con tecniche di imaging 2-dimensionale., Come nelle procedure come la sostituzione percutanea della valvola aortica, il TEE 3-dimensionale o la tomografia cardiaca possono fornire informazioni spaziali che possono aiutare a ottimizzare la strategia di impianto e la selezione delle dimensioni del dispositivo.
Il significato delle perdite periprotesiche durante il follow-up rimane incerto. Una subanalisi dello studio PROTECT AF non ha trovato alcuna relazione tra perdite e comparsa di eventi clinici., Al contrario, negli studi sugli esiti della cardiochirurgia coronarica, l’escissione incompleta di LAA in pazienti con occlusione profilattica chirurgica di LAA è stata associata ad un più alto tasso di eventi cardioembolici. Mentre aspettiamo che nuovi studi diventino disponibili che possano o meno confermare questa relazione, dovremmo cercare di prevenire perdite periprotesiche. Pertanto, si raccomanda che il dispositivo sia leggermente più grande di TEE e le misure angiografiche suggerirebbero, in quanto ciò consente di ridurre il tasso di perdite residue senza aumentare il rischio di rottura della parete LAA.,13
Le raccomandazioni antitrombotiche postprocedurali sono un’altra questione controversa. Nello studio PROTECT AF, l’OAC è stato somministrato per 45 giorni dopo l’impianto e sospeso se il TEE ha mostrato un’adeguata occlusione della LAA.12 Recentemente, lo studio ASAP ha dimostrato che 45 giorni di trattamento con OAC possono sostituire la doppia terapia antipiastrinica (100 mg/die di acido acetilsalicilico e 75 mg/die di clopidogrel).14 Attualmente, la maggior parte dei centri consiglia antiaggreganti doppi per 1 a 3 mesi e monoterapia antiaggregante indefinita., La trombosi del dispositivo è una complicazione rara ma è stata descritta sia nei dispositivi Watchman™ che ACP. Sebbene questa complicanza si risolva entro 2 settimane di terapia anticoagulante nella maggior parte dei pazienti, il potenziale rischio di embolia dovuto alla migrazione dei trombi la rende una delle complicanze più temute., Nel solo serie spagnola ha riferito, un tasso allarmante di dispositivo trombosi è stata osservata nel 14% dei pazienti, in contrasto con il 15 Questa differenza nella percentuale di trombosi potrebbe essere dovuto a una differenza di sensibilità di rilevazione: nel registro spagnolo, il TEE di follow-up protocollo è stato molto più lungo (24 h e 1, 3, 6 e 12 mesi) che nella maggior parte dei centri studiato, dove TEE è stata usata per 3 a 6 mesi.,Dato che la maggior parte dei casi di trombosi si è verificata a = 3 mesi e tutti sono stati risolti somministrando eparina sodica o enoxaparina per 2 settimane, determinare la fattibilità di 3 mesi di terapia anticoagulante o un follow-up più esaustivo potrebbe essere un’opzione futura, una volta chiarita la vera incidenza della trombosi del dispositivo. In ogni caso, è necessaria una valutazione multidisciplinare e individualizzata in pazienti di questo tipo, che a volte presentano un rischio di sanguinamento così elevato che anche brevi periodi di terapia anticoagulante potrebbero essere controindicati.,
CONCLUSIONI E PROSPETTIVE PER IL FUTURO
Anche se la NVAF è già una delle malattie più frequenti nella nostra società, la sua prevalenza aumenterà nei prossimi anni a causa del progressivo invecchiamento della popolazione. Per diversi motivi, tra il 30% e il 50% dei pazienti indicati per OAC non li assumono. Oggi, l’occlusione LAA costituisce un’alternativa per i pazienti con NVAF e controindicazioni per la terapia anticoagulante., L’occlusione LAA è una procedura efficiente e sicura, ma richiede un team con esperienza in cardiologia interventistica strutturale ed è associata a una sostanziale curva di apprendimento per l’operatore.
In futuro, l’occlusione LAA potrebbe essere un’alternativa al trattamento OAC per tutti i pazienti con NVAF. Sebbene lo studio PROTECT AF abbia già dimostrato che l’efficacia dell’occlusione LAA non è inferiore a quella della terapia anticoagulante, la curva di apprendimento iniziale ha condizionato un alto tasso di complicanze periprocedurali., Due nuovi studi randomizzati-PREVAIL e ACP-confronteranno specificamente l’occlusione LAA con il trattamento OAC in pazienti con NVAF una volta superata la curva di apprendimento della procedura iniziale. Lo studio PREVAIL confronta il dispositivo Watchman™ con warfarin e ACP confronta il dispositivo ACP con warfarin e dabigatran. Se i risultati di entrambi gli studi dimostrano che l’occlusione di LAA non ha meno successo della terapia anticoagulante nei pazienti con NVAF, l’uso della procedura potrebbe essere esteso e potrebbe diventare un’alternativa alla terapia anticoagulante per i pazienti con un profilo di rischio inferiore.,
CONFLITTI DI INTERESSE
Xavier Freixa è proctor di St. Jude Medical.