Atomi e Energia di Luce
Lo studio degli atomi e delle loro caratteristiche si sovrappongono diversi differentsciences. Chimici, fisici e astronomi devono tutti comprendere la scala microscopica in cui gran parte dell’Universo funziona per vedere un “quadro più ampio”.,
All’interno dell’atomo
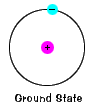 |
Lo stato fondamentale di un elettrone, il livello di energia che occupa normalmente, è lo stato di energia più bassa per quell’elettrone. |
| C’è anche un’energia massima che ogni elettrone puòavere ed essere ancora parte del suo atomo. Oltre a questa energia, l’elettron non è più legato al nucleo dell’atomo ed è considerato ionizzato., | 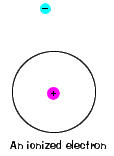 |
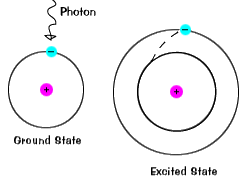 |
Quando un elettrone temporaneamente ospitato in un stato di energia maggiore di itsground stato, si trova in uno stato eccitato.Un elettrone può diventare eccitato se si è dato un extra di energia, come se itabsorbs un fotone, o un pacchetto di luce, o si scontra con un vicino di atomo o particella. |
Energia luminosa
Le illustrazioni di questa pagina sono versioni semplificate di atomi reali,ovviamente. Gli atomi reali,anche quelli relativamente semplici come l’idrogeno, hanno molti orbitali diversi, e quindi ci sono molte energie possibili con diversi stati iniziali e finali., Quando un atomo è eccitatostato, l’elettrone può cadere fino allo stato fondamentale in una volta sola,o fermarsi sulla strada in un livello intermedio.
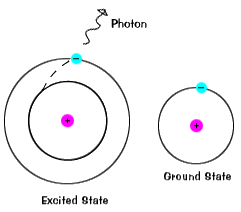 |
Gli elettroni non rimangono in stati eccitati per molto tempo – prestoritorno ai loro stati di terra, emettendo un fotone con la stessa energia di quella che è stata assorbita., |
Identificazione di singoli tipi di atomi
Le transizioni tra i vari orbitali sono uniche per ogni elemento perché i livelli di energia sono determinati in modo univoco dai protoni e dai neutroni nel nucleo. Sappiamo che diversi elementi hanno numeri diversi diprotoni e neutroni nei loro nuclei. Quando gli elettroni di un certo atomo ritornano a orbitali inferiori da stati eccitati, i fotoni che emettono hanno energie che sono caratteristiche di quel tipo di atomo., Ciò conferisce a ciascun elemento un’impronta digitale unica, che consente di identificare gli elementi presenti in un contenitore di gas o persino in una stella.
Possiamo usare strumenti come la tavola periodica degli elementi per capire esattamente quanti protoni, e quindi elettroni, ha un atomo. Prima di tutto, sappiamo che affinché un atomo abbia una carica neutra, deve avere lo stesso numero diprotoni ed elettroni. Se un atomo perde o guadagna elettroni, diventasionizzato o caricato. La tavola periodica ci darà il numero atomico diun elemento. Il numero atomico ci dice quanti protoni un atomohas., Ad esempio, l’idrogeno ha un numero atomico di uno – il che significa che haun protone, e quindi un elettrone-e in realtà non ha neutroni.
Per lo studente
In base alla precedente descrizione dell’atomo, disegnare un modello dell’atomo di idrogeno. Il modello” standard ” di un atomo è notocome il modello di Bohr.
Diverse forme dello stesso elemento chimico che differiscono solo per il numerodi neutroni nel loro nucleo sono chiamati isotopi. La maggior parte degli elementi havemore di un isotopo naturale., Molti altri isotopi sono statiprodotti nei reattori nucleari e nei laboratori scientifici. Gli isotopi di solito non sono molto stabili e tendono a subire il decadimento radioattivo fino a quando non si forma qualcosa di più stabile. Potresti avere familiarità con l’elementuranio – ha diversi isotopi instabili, U-235 è uno dei piùcomuni conosciuti. Il 235 significa che questa forma di uranio ha 235 neutroni e protoni combinati. Se cercassimo il numero atomico dell’uranio e lo sottraessimo da 235, potremmo calcolare il numero di neutroni che ha l’isotopo.,
Ecco un altro esempio: il carbonio di solito si presenta sotto forma di C – 12 (carbonio-12), cioè 6 protoni e 6 neutroni, sebbene un isotopo sia C-13, con 6protoni e 7 neutroni.
Per lo Studente
Usa la tavola periodica e i nomi degli elementi indicati di seguito per capire quanti protoni, neutroni ed elettroni hanno.Disegna un modello di un atomo del seguente elemento: silicio-28, magnesio-24, zolfo-32, ossigeno-16 ed elio-4.,
Per lo Studente
Utilizzando il testo, definire i seguenti termini: livelli di energia, assorbimento, emissione, stato eccitato, stato fondamentale, ionizzazione,atomo, elemento, massa atomica, numero atomico, isotopo.
Una nota facoltativa sulla natura meccanica quantistica degli atomiMentre l’atomo di Bohr descritto sopra è un bel modo per conoscere la struttura degli atomi, non è il modo più accurato per modellarli., Sebbene ogni orbitale abbia un’energia precisa, l’elettrone è ora immaginato come spalmato in una “nube di elettroni”che circonda il nucleo. È comune parlare della distanza media dalcloud come il raggio dell’elettrone orbit.So basta ricordare, manterremo le parole “orbita” e “orbitale”, anche se noi arenow li usa per descrivere non un piano orbitale piatto, ma aregion dove un elettrone ha una probabilità di essere. Gli elettroni sono tenuti vicino alucleo dall’attrazione elettrica tra il nucleo e gli elettroni.,Tenuto lì nello stesso modo in cui i nove pianeti rimangono vicino al Sole invece diradando la galassia. A differenza del sistema solare, dove tutte le orbite dei pianetisono sullo stesso piano, le orbite degli elettroni sono più tridimensionali. Ciascunolivello energetico su un atomo ha una forma diversa. Ci sono equazioni matematiche che ti diranno la probabilità della posizione dell’elettrone all’interno di quell’orbita. Consideriamo l’atomo di idrogeno, di cui abbiamo già disegnato un modello di Bohr.,
Il testo e le immagini di questa sezione sono stati adattati dalla pagina di Dave Slaven sull’Atomo (vedi Riferimenti sotto). |

