Un breve riassunto del processo Haber
Il processo Haber combina l’azoto dell’aria con l’idrogeno derivato principalmente dal gas naturale (metano) in ammoniaca. La reazione è reversibile e la produzione di ammoniaca è esotermica.,
![]()
![]()
Uno schema di flusso per il Processo Haber assomiglia a questo:
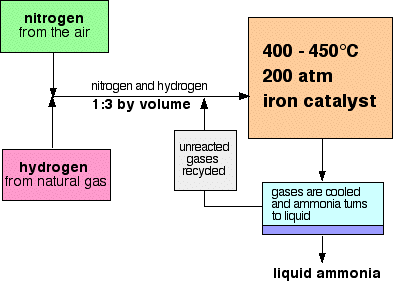
Alcune note sulle condizioni
Il catalizzatore
Il catalizzatore è in realtà leggermente più complicato di ferro puro. Ha aggiunto idrossido di potassio come promotore – una sostanza che aumenta la sua efficienza.
La pressione
La pressione varia da un impianto produttivo all’altro, ma è sempre elevata. Non puoi sbagliare molto in un esame che cita 200 atmosfere.,
Riciclaggio
Ad ogni passaggio dei gas attraverso il reattore, solo circa il 15% dell’azoto e dell’idrogeno si converte in ammoniaca. (Questa cifra varia anche da pianta a pianta.) Riciclando continuamente l’azoto e l’idrogeno non reagiti, la conversione complessiva è di circa il 98%.
Spiegare le condizioni
Le proporzioni di azoto e idrogeno
La miscela di azoto e idrogeno che entra nel reattore è nel rapporto di 1 volume di azoto a 3 volumi di idrogeno.,
La Legge di Avogadro dice che volumi uguali di gas alla stessa temperatura e pressione contengono un numero uguale di molecole. Ciò significa che i gas entrano nel reattore nel rapporto tra 1 molecola di azoto e 3 di idrogeno.
Questa è la proporzione richiesta dall’equazione.
In alcune reazioni si potrebbe scegliere di utilizzare un eccesso di uno dei reagenti. Lo faresti se è particolarmente importante consumare il più possibile l’altro reagente-se, ad esempio, fosse molto più costoso. Questo non vale in questo caso.,
C’è sempre un lato negativo nell’usare qualcosa di diverso dalle proporzioni dell’equazione. Se hai un eccesso di un reagente ci saranno molecole che passano attraverso il reattore che non possono reagire perché non c’è nulla con cui reagire. Ciò spreca lo spazio del reattore, in particolare lo spazio sulla superficie del catalizzatore.
La temperatura
Considerazioni di equilibrio
È necessario spostare la posizione dell’equilibrio il più lontano possibile verso destra per produrre la massima quantità possibile di ammoniaca nella miscela di equilibrio.,
La reazione diretta (la produzione di ammoniaca) è esotermica.
![]()
![]()
Secondo il principio di Le Chatelier, questo sarà favorito se si abbassa la temperatura. Il sistema risponderà spostando la posizione di equilibrio per contrastare questo – in altre parole producendo più calore.
Per ottenere più ammoniaca possibile nella miscela di equilibrio, è necessaria una temperatura più bassa possibile. Tuttavia, 400-450°C non è una bassa temperatura!,
Considerazioni sulla velocità
Più bassa è la temperatura utilizzata, più lenta diventa la reazione. Un produttore sta cercando di produrre più ammoniaca possibile al giorno. Non ha senso cercare di ottenere una miscela di equilibrio che contiene una percentuale molto elevata di ammoniaca se ci vogliono diversi anni perché la reazione raggiunga tale equilibrio.
È necessario che i gas raggiungano l’equilibrio entro il brevissimo tempo in cui saranno in contatto con il catalizzatore nel reattore.,
Il compromesso
400 – 450°C è una temperatura di compromesso che produce una percentuale ragionevolmente elevata di ammoniaca nella miscela di equilibrio (anche se è solo del 15%), ma in un tempo molto breve.
pressione
Equilibrio considerazioni
![]()
![]()
si Noti che ci sono 4 molecole sul lato sinistro dell’equazione, ma solo 2 a destra.,
Secondo il principio di Le Chatelier, se si aumenta la pressione il sistema risponderà favorendo la reazione che produce meno molecole. Che farà sì che la pressione a cadere di nuovo.
Per ottenere più ammoniaca possibile nella miscela di equilibrio, è necessaria una pressione più alta possibile. 200 atmosfere è un’alta pressione, ma non incredibilmente alta.
Considerazioni sulla velocità
L’aumento della pressione avvicina le molecole., In questo caso particolare, aumenterà le loro possibilità di colpire e attaccare alla superficie del catalizzatore dove possono reagire. Maggiore è la pressione, migliore è la velocità di reazione del gas.
Considerazioni economiche
Le pressioni molto elevate sono molto costose da produrre su due fronti.
È necessario costruire tubi estremamente resistenti e contenitori di contenimento per resistere alla pressione molto elevata. Che aumenta i costi di capitale quando l’impianto è costruito.
Le alte pressioni costano molto da produrre e mantenere., Ciò significa che i costi di gestione del vostro impianto sono molto elevati.
Il compromesso
200 atmosfere è una pressione di compromesso scelta per motivi economici. Se la pressione utilizzata è troppo alta, il costo di generarla supera il prezzo che si può ottenere per l’ammoniaca extra prodotta.
Il catalizzatore
Considerazioni sull’equilibrio
Il catalizzatore non ha alcun effetto sulla posizione dell’equilibrio. L’aggiunta di un catalizzatore non produce alcuna percentuale maggiore di ammoniaca nella miscela di equilibrio. La sua unica funzione è accelerare la reazione.,
Considerazioni sulla velocità
In assenza di un catalizzatore la reazione è così lenta che praticamente nessuna reazione avviene in qualsiasi momento ragionevole. Il catalizzatore assicura che la reazione sia abbastanza veloce da consentire un equilibrio dinamico entro il brevissimo tempo in cui i gas sono effettivamente nel reattore.
Separare l’ammoniaca
Quando i gas escono dal reattore sono caldi e ad una pressione molto alta., L’ammoniaca è facilmente liquefatta sotto pressione finché non è troppo calda, e quindi la temperatura della miscela è abbassata abbastanza per l’ammoniaca per trasformarsi in un liquido. L’azoto e l’idrogeno rimangono come gas anche sotto queste alte pressioni e possono essere riciclati.
Domande per testare la tua comprensione
Se questa è la prima serie di domande che hai fatto, leggi la pagina introduttiva prima di iniziare. Sarà necessario utilizzare il pulsante INDIETRO sul browser per tornare qui in seguito.,
domande sul processo Haber
risposte
Dove vorresti andare ora?
Al menu equilibrio . . .
Al menu Chimica fisica . . .
Al menu principale . . .