Introduzione
Durante l’inverno, a volte dermatologi ricevere pazienti asintomatici, senza particolari lesioni, oltre, forse, alcuni post-infiammatorie scolorimento, ma con un disperato bisogno di aiuto. Iniziano a raccontare la storia di un certo numero di papule o vescicole che appaiono sulla loro pelle dopo la prima intensa esposizione al sole dell’anno., Insieme alle lesioni, inizia un terribile prurito e aumenta con la diffusione della malattia, in seguito alla successiva esposizione al sole, talvolta aggravata da una sorta di sensazione di bruciore. Tuttavia, queste persone sono in cerca di sole modello e continuano a godersi il sole per tutta l’estate, in attesa che le papule svaniscano gradualmente e scompaiano. Le domande principali sono: come posso prevenirlo? Perché ho questo problema da ” 5 ” anni, ma non l’ho mai avuto prima?,
Molto probabilmente abbiamo a che fare con l’eruzione polimorfica della luce (PLE) e, seguendo le richieste dei nostri pazienti, la ricerca medica si è concentrata principalmente su strategie di prevenzione diventate oggi abbastanza soddisfacenti. D’altra parte, la seconda e certamente meno esplorata domanda rimane poco chiara, a meno che non siano stati aggiunti più pezzi a questo puzzle piuttosto complicato. Scopo di questa breve rassegna è quello di riprendere i più recenti progressi nei meccanismi possibili PLE e protocolli più utilizzati per la prevenzione o il trattamento.
Patofisiologia dell’eruzione polimorfica della luce: cosa c’è di nuovo?,
PLE è il disturbo fotosensibile più comune, caratterizzato da un’eruzione intermittente di papule eritematose pruriginose non cicatrizzate, vescicole o placche (Figura 1) che si sviluppano entro ore dall’esposizione alla radiazione ultravioletta (UVR) della pelle del paziente. La malattia dipende dalla suscettibilità genetica, nonché dalla componente ambientale, come il tipo di esposizione. PLE sembra raggrupparsi in famiglie: è stato stimato che la prevalenza di PLE era 21 e 18% nei gemelli monozigoti e dizigoti, rispettivamente (1)., Inoltre, una storia familiare positiva di PLE nei parenti di primo grado era presente nel 12% delle coppie gemellari interessate rispetto al 4% delle coppie gemellari non affette (p < 0,0001). La concordanza probandwise nei monozigoti è stata superiore rispetto alle coppie gemellari dizigotiche (0,72 vs. 0,30, rispettivamente), dimostrando un forte effetto genetico (1). Molti geni di potenziale interesse nella patogenesi della PLE sono stati studiati con risultati generalmente non gratificanti., Utilizzando l’analisi della segregazione, è stato stimato che il 72% della popolazione del Regno Unito possiede un allele di suscettibilità PLE a bassa penetranza (2).
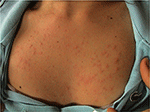
Figura 1. Quadro clinico di eruzione leggera polimorfica in una giovane donna.
Il fallimento dell’apoptosi: i possibili antigeni Neo Foto-indotti
In una recente analisi di espressione genomica, solo 16 geni sono stati espressi in modo differenziale tra PLE e controlli sani dopo irradiazione UV rispetto al controllo (3)., Di questi geni, 14 hanno mostrato un’espressione inferiore nei pazienti con PLE, mentre due sono risultati sovraespressi. Tra i 14 geni con minore espressione in PLE sono: complemento 1s subunità (C1s), scavenger recettore B1 (SCARB1) fibronectina (FN1), immunoglobuline superfamiglia membro 3 (IGSF3), caspasi-1 (CASP1) e paraoxonase 2 (PON2), tutti i geni associati con clearance cellulare apoptotica. Si è supposto che la modificazione delle proteine durante la clearance cellulare apoptotica potrebbe portare alla potenziale formazione di auto-antigene (4)., Quindi, la ridotta espressione nei pazienti PLE di geni collegati a questo processo potrebbe rappresentare una possibile fonte di auto-antigene, nonché una fase cruciale nell’avvio del processo autoimmune che promuove la malattia (3). In conformità a questi risultati, Kuhn et al. ha mostrato accumulo di cellule apoptotiche in pazienti con PLE irradiati con 1,5 dosi minime di eritema (MED) di UVB, o 60-100 J/cm2 di UVA1, rispetto ai controlli (5).,
Immunità: Fallimento della tolleranza
Gli auto-antigeni derivanti dalla clearance inefficiente delle cellule apoptotiche, sono probabilmente assorbiti dalle cellule dendritiche (DCs) e presentati alle cellule T ingenue (citotossiche e helper) successivamente trasformate in cellule T auto-reattive (6, 7). Questo parziale fallimento dell’apoptosi contribuisce, insieme all’inadeguata immunosoppressione dopo esposizione ai raggi UV, al riconoscimento e alla presentazione dell’antigene, portando alla manifestazione clinica tipica dei pazienti con PLE (8)., Infatti, il fallimento della normale immunosoppressione indotta da UVR è stato dimostrato come la principale anomalia immunologica nella PLE, spiegata, inizialmente, dalla permanenza delle cellule di Langerhans (LCs) nell’epidermide. Questa eccessiva attivazione del sistema immunitario, che sfugge alla tolleranza funzionale indotta dai raggi UV, è probabilmente responsabile della ridotta prevalenza del cancro della pelle nei pazienti con PLE (9). D’altra parte, lo stesso meccanismo è colpevole per il fallimento della soppressione della dermatite allergica da contatto (ACD), dopo l’esposizione ai raggi UVR (10).,
Via infiammatoria: Reazione di ipersensibilità di tipo ritardato
I meccanismi immunologici coinvolti nella PLE, con mediatori del sistema immunitario innato e adattativo, sono molto simili, sia dal punto di vista istologico che biochimico, a quelli ACD. In effetti, nei primi anni Settanta, Epstein indicò per la prima volta la PLE come reazione di ipersensibilità di tipo ritardato (DTHR) all’antigene cutaneo indotto da UVR non definito (11). Recentemente, per rafforzare questo concetto, alcuni dei mediatori infiammatori coinvolti in ACD sono stati dimostrati anche in PLE., Ad esempio, la famiglia IL-1 (12, 13), un gruppo crescente di citochine che svolgono diversi ruoli nella regolazione immunitaria e nell’infiammazione (14), coinvolta anche nella patogenesi dell’ACD (12, 15), è stata esplorata anche in PLE (16). IL-36α e IL-36γ, i membri pro-infiammatori della famiglia IL-1 sono stati aumentati in PLE rispetto ai controlli, come per i campioni di ACD, ma IL-36γ è stato molto migliorato in PLE rispetto a ACD (16). Agendo attraverso il recettore comune composto da IL-36R e IL-1R/AcP (IL-1RL2), IL-36α, IL-36β e IL-36γ attivano NF-kB e MAPKs, promuovendo reazioni infiammatorie., L’aumento di IL-36s in pelle e sangue periferico di pazienti di PLE indica l’attivazione di risposta immunitaria locale e sistemica, come trovato in condizioni cutanee infiammatorie multiple (15, 17, 18). Probabilmente, il legame tra IL-36s e l’esposizione ai raggi UVR è rappresentato dal segnale pro-infiammatorio paracrino dell’attivazione del recettore toll like (TLR)-3, dovuto al rilascio di RNA da parte dei cheratinociti necrotici (19). Infatti, il fallimento della clearance apoptotica in PLE, con abbondanza di detriti cellulari, potrebbe essere responsabile di un’amplificazione di questo “segnale di allarme.,”
Inoltre, IL-36s potrebbe contribuire ad amplificare il segnale immunitario innato e la conseguente cascata infiammatoria, promuovendo peptidi antimicrobici (AMPs) (20).
Via infiammatoria: AMPs e Microbioma
Come ampiamente esaminato in più processi infiammatori cutanei, questi mediatori, denominati come defensine (α e β), catelicidina (LL37), ribonucleasi 7 (RNase7) e psoriasina (S100A7), alla luce dello squilibrio indotto dall’UVR sui cheratinociti e sul microbioma cutaneo, sono stati studiati anche in PLE (21, 22). Patra et al., hanno trovato che l’espressione di psoriasin, RNase7, HBD-2 e LL-37 era aumentata in pelle lesionale di PLE, mentre HBD-3 era diminuita. Considerando la superficie della pelle come un “mondo multietnico”, senza dimenticare il ruolo cruciale dei cheratinociti, non possiamo escludere che il rilascio di AMPs possa essere determinato dalla modifica dei componenti del microbioma dopo l’interazione UV (23). In effetti, il microbioma potrebbe rappresentare la fonte, diretta o indiretta, degli antigeni indotti dall’UVR ancora non rilevati formati nei pazienti con PLE, portando a danni ai cheratinociti., Di conseguenza, LL-37, anche indotto da UVB, IFNy, TNF-α, IL-6, potrebbe rappresentare un potenziale driver indiretto di PLE (23). Può formare aggregati con acidi auto-nucleici in grado di attivare i PDC: nella psoriasi è stato riconosciuto come il principale autoantigene (24). Anche se nei pazienti con PLE è stata riportata una completa assenza di pDCs (25), esiste un ambiente autoimmune e LL-37 potrebbe svolgere un ruolo fondamentale, inducendo altre vie infiammatorie. Nella figura S1 (Materiale supplementare), i concetti espressi sopra sono visualizzati in un fumetto.
Terapia dell’eruzione della luce polimorfica: cosa c’è di nuovo?,
La prima linea di trattamento per la PLE comprende la prevenzione del sole, i filtri solari e i corticosteroidi topici (26). Per tutti i pazienti la gestione preventiva è fondamentale durante il tempo soleggiato, evitando l’esposizione intensa ai raggi UVR e l’uso di indumenti protettivi, nonché l’applicazione di creme solari, in particolare durante la prima esposizione dell’anno. I filtri solari ad ampio spettro di nuova generazione, con un elevato fattore di protezione solare per UVB (SPF), insieme alla protezione UVA a lunghezza d’onda più lunga, sono stati segnalati per conferire protezione totale o parziale fino al 90% dei pazienti con PLE (27, 28)., L’uso di antiossidanti orali e nicotinamide potrebbe rappresentare un’ulteriore valida misura preventiva per questi pazienti. Gli effetti benefici della nicotinamide sono stati studiati in uno studio non controllato su 42 pazienti, in cui il 60% di essi ha riportato la completa abolizione dei sintomi durante l’assunzione di 2-3 g di nicotinamide al giorno, prima dell’esposizione al sole (29). Inoltre, un estratto della felce tropicale Polypodiumleucotomos [PL) ha dimostrato di esercitare sia potenti effetti antiossidanti che immunomodulatori., Quando somministrato a 480 mg / die prima dell’esposizione al sole ha ridotto significativamente le reazioni cutanee e i sintomi soggettivi (30, 31). Per quanto riguarda i corticosteroidi topici, anche se non sono stati effettuati studi per determinare la loro efficacia nella PLE, sono ampiamente utilizzati per ridurre il prurito (26). La seconda linea di trattamenti per PLE comprende corticosteroidi sistemici e foto(chemio)terapia (26). In uno studio randomizzato, in doppio cieco, controllato con placebo (32) gli autori hanno suggerito l’uso di 25 mg di prednisolone al giorno per 4-5 giorni all’inizio dell’eruzione., Sebbene, i potenziali effetti collaterali a lungo termine di cicli ripetuti di prednisolone devono essere considerati, potrebbe essere consigliato per i pazienti che soffrono di attacchi occasionali di PLE, in assenza di controindicazioni. Nei casi più lievi di PLE, può essere sufficiente un programma di auto-condizionamento mediante esposizione dei laureati alla luce solare in primavera (33). Considerando che, nei casi più gravi, il trattamento di condizionamento/desensibilizzazione sotto controllo medico può essere più appropriato., Un ciclo di psoraleni e UVA terapia (PUVA), banda stretta (NB)-UVB o banda larga (BB)-UVB fototerapia, di solito somministrato all’inizio della primavera, può essere efficace così come il trattamento profilattico (26). Il protocollo di trattamento consiste generalmente in un ciclo di fototerapia/fotochemioterapia nell’arco di 5-6 settimane. Le dosi iniziali dipendono dalla dose eritemica minima (MED) o dalla dose fototossica minima (MPD) e sono frequentemente il 50-70% di queste soglie misurate con incrementi incrementali., Per mantenere il beneficio acquisito con la terapia desensibilizzante, si consiglia una regolare esposizione al sole per tutta l’estate, altrimenti l’indurimento potrebbe essere perso entro 4-6 settimane. Nel trattamento della PLE, NB-UVB deve essere preferito a PUVA (forza della raccomandazione D; livello di evidenza 4), a causa del minor rischio di fotocarcinogenesi, nessun rischio di nausea o altri effetti collaterali associati all’ingestione di MOP e nessuna necessità di utilizzare la protezione per gli occhi post-trattamento. Tuttavia, PUVA deve essere considerato, prima di altri trattamenti sistemici, se NB-UVB ha fallito o ha precedentemente innescato l’eruzione., In effetti, come descritto di seguito, l’efficacia è stata dimostrata per più regimi di fototerapia (BB-UVB, NB-UVB e PUVA), e gli effetti collaterali, in termini di provocazione cutanea, eritema e prurito sono risultati essere più comuni con UVB che con PUVA (34). Come riassunto, in letteratura, l’efficacia di PUVA si traduce in un tasso di fotoprotezione del 65-100% (34)., Sono stati condotti più studi comparativi, ma dall’unico studio controllato randomizzato tra PUVA e NB-UVB più compresse placebo, tre volte alla settimana, per 5 settimane, non è emersa alcuna differenza significativa nell’efficacia, considerando l’insorgenza di PLE o restrizione dell’attività all’aperto (35). Nella recensione retrospettiva di 10 anni, riportata da Man et al. (36), 170 pazienti con PLE da moderato a grave hanno ricevuto fototerapia PUVA e/o UVB. In dettaglio, 8 pazienti hanno ricevuto PUVA, 128 NB-UVB, 5 BB-UVB e 29 pazienti, che non hanno risposto in modo soddisfacente a NB-UVB, hanno ricevuto PUVA l’anno successivo., Sono state fatte autovalutazioni della gravità e la frequenza degli episodi di PLE è stata riportata alle visite di follow-up in autunno o durante la primavera successiva. Un miglioramento buono o moderato è stato riportato nell ‘88% dei pazienti trattati con PUVA e nell’ 89% che hanno ricevuto UVB. Dei pazienti trattati sia con PUVA che con NB-UVB, la maggioranza ha preferito PUVA. In un altro studio retrospettivo della durata di 14 anni su 79 pazienti trattati con fototerapia (37), l’efficacia, misurata durante l’estate successiva in termini di fotoprotezione con remissione completa/parziale, è stata del 65% per PUVA, dell ‘82% per BB-UVB e dell’ 83% per i soli UVA., In questo caso il trattamento con PUVA è stato riservato alle forme di PLE più gravi.
I meccanismi con cui la fototerapia induce la fotoprotezione non sono completamente compresi.
Tuttavia, negli ultimi anni sono stati compiuti molti progressi. Oltre agli effetti ben noti sulla melaninizzazione e l’ispessimento epidermico della fototerapia, viene riportata una vasta gamma di proprietà immunomodulatorie e antinfiammatorie indotte dai raggi UV (38)., Sia UVB che UVA modulano l’espressione della molecola di adesione e inducono mediatori solubili, come l’ormone stimolante i melanociti, IL-10 (che sopprime la produzione di interferone γ) e prostaglandina E2, che esplicano azioni antinfiammatorie, prevenendo l’attivazione delle cellule T e promuovendo l’apoptosi delle cellule T infiltranti della pelle (34). Inoltre, è stato dimostrato che il fotoindurimento profilattico UV nei pazienti con PLE ripristina la migrazione LC indotta dai raggi UV dall’epidermide ai linfonodi drenanti della pelle: uno degli eventi cellulari chiave nell’immunosoppressione UV (39)., La tolleranza indotta da LC è mediata dal rilascio di citochina immunosoppressiva come IL-10 e dall’interferenza con la maturazione e l’induzione delle cellule T regolatorie (Tregs) (40). Inoltre, recentemente, è stato segnalato un interessante collegamento tra LC, Tregs e vitamina D3. In effetti, è stato dimostrato che un pre-trattamento topico a breve termine di 1 settimana con l’analogo della 1,25-diidrossivitamina D, calcipotriolo, diminuiva i sintomi della PLE dopo successiva fotoprovocazione sperimentale (41)., Inoltre, in uno studio murino la 1,25-diidrossivitamina D ha mostrato effetti immunosoppressivi comparabili come UV (42). Un altro crosstalk interessante è stato evidenziato tra LCs e mastociti. Oltre al loro ruolo riconosciuto nell’atopia, i mastociti dermici sono anche responsabili della protezione della pelle dall’infiammazione indotta da UVB, promuovendo l’immunosoppressione UV (40). Studi sull’uomo hanno dimostrato che dopo l’esposizione UVR acuta e cronica, il numero di mastociti dermici aumenta, insieme al rilascio di IL-10., Nel complesso questi dati suggeriscono un ruolo potenziale per i mastociti nel PLE e nel meccanismo di fotoindurimento. In accordo con questo, Wolf et al. hanno riferito, per la prima volta, che il fotoindurimento aumenta significativamente la densità dei mastociti nel derma papillare dei pazienti con PLE (40). Riassumendo, photohardening funziona in PLE ripristinando la normale via soppressiva immunitaria UV, che coinvolge più tipi di cellule. Il trattamento di terza linea per PLE include l’uso di farmaci immunosoppressori sistemici, come azatioprina e ciclosporina., Tuttavia, solo casi sporadici di pazienti trattati con successo sono riportati in letteratura (43, 44). Inoltre, l’idrossiclorochina, gli acidi grassi omega-3 e il beta-carotene sono stati proposti come trattamenti, ma sono necessari ulteriori studi controllati randomizzati in doppio cieco per valutare realmente la loro efficacia clinica.
Conclusioni
Poiché l’alta prevalenza e la crescente incidenza di PLE, associata a disagio e restrizioni dello stile di vita, sono necessari studi futuri per trovare nuove strategie terapeutiche e / o preventive., La scelta del trattamento PLE appropriato richiede una buona conoscenza del decorso clinico individuale della malattia insieme alla possibilità di eseguire il fototest. Sono stati evidenziati alcuni nuovi aspetti nella possibile attivazione e promozione del processo infiammatorio.,
allo stato attuale delle conoscenze, nonostante l’identificazione di alcuni cruciali cellulare regolamento coinvolto il restauro della tolleranza immunitaria, è difficile trarre conclusioni precise circa l’efficacia dei vari potenziali trattamenti in PLE, a causa della mancanza di studi adeguati e la difficoltà nel valutare le misure di outcome. Il punteggio clinico per valutare la gravità della PLE (PLESI) (45) rimane uno strumento scarsamente utilizzato e principalmente limitato a scopi di ricerca., Lo studio più approfondito dei meccanismi patogenetici sottostanti del disturbo consentirà un approccio terapeutico più mirato.
Contributi dell’autore
SL ha proiettato il manoscritto, selezionato il materiale per la carta, scritto la bozza iniziale e corretto le seguenti bozze del manoscritto. AR era impegnato nella scrittura del manoscritto, sostenendo nuove idee di contenuti e stile.,
Dichiarazione sul conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Materiale supplementare
Figura S1. Interazione tra sistema immunitario innato e adattativo in un contesto di fallimento dell’apoptosi nell’epidermide. (Simbolo verde) Psoriasin: espressione abbondante negli strati spinosi e granulari di pelle di PLE. (Simbolo blu) RNase7: espresso principalmente nei cheratinociti dello strato granuloso e dello strato corneo delle lesioni PLE., (Simbolo giallo) LL-37 è stato profondamente espresso in e intorno vasi sanguigni e ghiandole in PLE. (Simbolo cellulare viola) Cheratinociti apoptotici con clearance inefficiente.,hic light eruption; ACD, Allergic contact dermatitis; DTHR, Delayed type hypersensitivity reaction; UVR, Ultraviolet radiation; C1s, Complement 1s subunit; SCARB1, Scavenger receptor B1; FN1, Fibronectin; IGSF3, Immunoglobulin superfamily member 3; CASP1, Caspase-1; PON2, Paraoxonase 2; MED, Minimal Erythema Dose; DCs, Dendritic cells; LCs, Langerhans cells; TLR, Toll like receptor; AMPs, Antimicrobial peptides; SPF, Sun protection factor; PUVA, Psoralen and UVA therapy; NB-UVB, Narrowband; BB-UVB, Broadband UVB; MPD, Minimum phototoxic dose; Tregs, Regulatory T cells; PL, Polypodiumleucotomos.,
2. McGregor JM, Grabczynska S, Vaughan R, Hawk JL, Lewis CM. Genetic modelling of abnormal photosensitivity in families with polymorphic light eruption and actinic prurigo. J Invest Dermatol. (2000) 115:471–6. doi: 10.1046/j.1523-1747.2000.00080.x
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Lembo S, Hawk JLM, Murphy GM, Kaneko K, Young AR, McGregor JM, et al., Aberrant gene expression with deficient apoptotic keratinocyte clearance may predispose to polymorphic light eruption. Br J Dermatol. (2017) 177:1450–3. doi: 10.1111/bjd.15200
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Savill J, Fadok V. Corpse clearance defines the meaning of cell death. Nature (2000) 407:784–8. doi: 10.,1038/35037722
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Kuhn A, Herrmann M, Kleber S, Beckmann-Welle M, Fehsel K, Martin-Villalba A, et al. Accumulation of apoptotic cells in the epidermis of patients with cutaneous lupus erythematosus after ultraviolet irradiation. Arthritis Rheum. (2006) 54:939–50. doi: 10.1002/art.21658
PubMed Abstract | CrossRef Full Text | Google Scholar
6., Savill J, Dransfield I, Gregory C, Haslett C. A blast from the past: clearance of apoptotic cells regulates immune responses. Nat RevImmunol. (2002) 2:965–75. doi: 10.1038/nri957
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Albert ML, Sauter B, Bhardwaj N. Dendritic cells acquire antigen from apoptotic cells and induce class I-restricted CTLs. Nature (1998) 392:86–9. doi: 10.,1038/32183
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Koulu LM, Laihia JK, Peltoniemi HH, Jansén CT. UV-induced tolerance to a contact allergen is impaired in polymorphic light eruption. J Invest Dermatol. (2010) 130:2578–82. doi: 10.1038/jid.2010.181
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Epstein JH. Polymorphous light eruption. J Am Acad Dermatol. (1980) 3:329–43.,
PubMed Abstract | Google Scholar
12. Mattii M, Ayala F, Balato N, Filotico R, Lembo S, Schiattarella M, et al. The balance between pro- and anti-inflammatory cytokines is crucial in human allergic contact dermatitis pathogenesis: the role of IL-1 family members. Exp Dermatol. (2013) 22:813–9. doi: 10.1111/exd.12272
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Dinarello CA., Interleuchina-1 nella patogenesi e nel trattamento delle malattie infiammatorie. Sangue (2011) 117:3720-32. doi: 10.1182 / sangue-2010-07-273417
PubMed Abstract | CrossRef Full Text/Google Scholar
16. Lembo S, Caiazzo G, Balato N, Monfrecola G, Patra V, Wolf P, et al. Eruzione leggera polimorfica e membri della famiglia IL-1: qualche differenza con la dermatite allergica da contatto? Photochem Photobiol Sci. (2017) 16:1471–9. doi: 10.,1039/c7pp00142h
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Balato A, Schiattarella M, Lembo S, Mattii M, Prevete N, Balato N, et al. Interleukin-1 family members are enhanced in psoriasis and suppressed by vitamin D and retinoic acid. Arch Dermatol Res. (2013) 305:255–62. doi: 10.1007/s00403-013-1327-8
PubMed Abstract | CrossRef Full Text | Google Scholar
19., Borkowski AW, Kuo IH, Bernard JJ, Yoshida T, Williams MR, Hung NJ. L’attivazione del recettore toll-like 3 è necessaria per la normale riparazione della barriera cutanea dopo il danno UV. J. Investire Dermatol. (2015) 135:569–78. doi: 10.1038 / jid.2014.354
PubMed Abstract | CrossRef Full Text/Google Scholar
20. Il suo nome deriva dal greco antico, che significa “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra” e “terra”. Funzione di Alarmin del peptide antimicrobico LL37 di cathelicidin con induzione IL-36γ in cheratinociti epidermici umani. J Immunolo., (2014) 193:5140–8. doi: 10.4049/jimmunol.1302574
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Patra V, Wolf P. Microbial elements as the initial triggers in the pathogenesis of polymorphic light eruption? Exp Dermatol. (2016) 25:999–1001. doi: 10.1111/exd.13162
PubMed Abstract | CrossRef Full Text | Google Scholar
22., Gläser R, Navid F, Schuller W, Jantschitsch C, Harder J, Schröder JM, et al. La radiazione UV-B induce l’espressione di peptidi antimicrobici nei cheratinociti umani in vitro e in vivo. J Allergia Clin Immunol. (2009) 123:1117–23. doi: 10.1016 / j.jaci.2009.01.043
PubMed Abstract | CrossRef Full Text/Google Scholar
23. Patra V, Mayer G, Gruber-Wackernagel A, Horn M, Lembo S, Wolf P., Profilo unico dell’espressione antimicrobica del peptide nelle lesioni polimorfiche dell’eruzione leggera confrontate alla pelle sana, alla dermatite atopica e alla psoriasi. Photodermatol Photoimmunol Photomed. (2018) 34:137–44. doi: 10.1111 / phpp.12355
PubMed Abstract | CrossRef Full Text/Google Scholar
25. Schweintzger NA, Gruber-Wackernagel A, Shirsath N, Quehenberger F, Obermayer-Pietsch B, Wolf P. Influenza delle stagioni sui livelli di vitamina D e cellule T regolatorie in pazienti con eruzione luminosa polimorfica., Photochem Photobiol Sci. (2016) 15:440–6. doi: 10.1039/c5pp00398a
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Proby C, Baker C, Morton O, Hawk JLM. New broad spectrum sunscreen for polymorphic light eruption. Lancet (1993) 341:1347–8.
PubMed Abstract | Google Scholar
28. Allas S, Lui H, Moyal D, Bissonnette R., Confronto della capacità di 2 filtri solari per proteggere contro polimorfa eruzione di luce indotta da una lampada ad alogenuri metallici UV-A/UV-B. Arch Dermatol. (1999) 135:1421–2.
PubMed Abstract/Google Scholar
29. Ortel B, Wechdorn D, Tanew A, Honigsmann H. Effetto della nicotinammide sulla reazione fototest in polimorfa lighteruption. Br J Dermatol. (1988) 118:669–73.
PubMed Abstract/Google Scholar
30., Caccialanza M, Percivalle S, Piccinno R, Brambilla R. Photoprotective activity of oral Polypodiumleucotomos extract in 25 patients with idiopathic photodermatoses. Photodermatol Photoimmunol Photomed. (2007) 23:46–7. doi: 10.1111/j.1600-0781.2007.00274.x
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Tanew A, Radakovic S, Gonzalez S, Venturini M, Calzavara-Pinton P. Oral administration of a hydrophilic extract of Polypodiumleucotomos for the prevention of polymorphic light eruption., J Am Acad Dermatol. (2012) 66:58–62. doi: 10.1016/j.jaad.2010.09.773
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Van Praag MCG Boom, BW, Vermeer BJ. Diagnosis and treatment of polymorphous light eruption. Int J Dermatol. (1994) 33:233–9.
Google Scholar
34. Ling TC, Clayton TH, Crawley J, Exton LS, Goulden V, Ibbotson S, et al., British association of dermatologists and british photodermatology group linee guida per l’uso sicuro ed efficace di psoralen-ultraviolet A therapy 2015. Br J Dermatol. (2016) 174:24–55. doi: 10.1111 / bjd.14317
PubMed Abstract | CrossRef Full Text/Google Scholar
36. Man I, Dawe RS, Ferguson J. Indurimento artificiale per l’eruzione della luce polimorfica: punti pratici dall’esperienza di dieci anni. Photodermatol Photoimmunol Photomed. (1999) 15:3–4.,
PubMed Abstract | Google Scholar
37. Mastalier U, Kerl H, Wolf P. Clinical laboratory, phototest and phototherapy findings in polymorphic light eruptions: a retrospective study of 133 patients. Eur J Dermatol. (1998) 8:554–9.
PubMed Abstract | Google Scholar
38. Krutmann J, Morita A. Mechanisms of ultraviolet (UV) B and UVA phototherapy. J Invest Dermatol Symp Proc. (1999) 4:70–2.,
PubMed Abstract | Google Scholar
39. Janssens AS, Pavel S, Out-Luiting JJ, Willemze R, de Gruijl FR. Normalized ultraviolet (UV) induction of Langerhans cell depletion and neutrophil infiltrates after artificial UVB hardening of patients with polymorphic light eruption. Br J Dermatol. (2005) 152:1268–74. doi: 10.1111/j.1365-2133.2005.06690.x
PubMed Abstract | CrossRef Full Text | Google Scholar
40., Wolf P, Gruber-Wackernagel A, Bambach I, Schmidbauer U,Mayer G, Absenger M, et al. Photohardening dei pazienti polimorfici dell’eruzione della luce diminuisce la densità epidermica basale delle cellule di Langerhans mentre aumenta il numero dei mastociti nel derma papillare. Scad Dermatolo. (2014) 23:428–30. doi: 10.1111 / exd.12427
PubMed Abstract | CrossRef Full Text/Google Scholar
42. Schwarz A, Navid F, Sparwasser T, Clausen BE, Schwarz T., 1,25-dihydroxyvitamin D exerts similar immunosuppressive effects as UVR but is dispensable for local UVR-induced immunosuppression. J Invest Dermatol. (2012) 132, 2762–9. doi: 10.1038/jid.2012.238
PubMed Abstract | CrossRef Full Text | Google Scholar
43. Norris PG, Hawk JL. Successful treatment of severe polymorphous light eruption with azathioprine. Arch Dermatol. (1989) 125:1377–9.
PubMed Abstract | Google Scholar