Ci sono quattro leggi, note come Leggi del gas, che descrivono come si comportano i gas. Le quattro leggi sono la Legge di Boyle, la Legge di Charles, la Legge di Gay-Lussac e la Legge di Avogadro.
Legge di Charles
Jacques Charles, un fisico francese, scoprì nel 1780 che il riscaldamento di un gas lo farà espandere di una certa frazione. L’immagine qui sotto mostra come l’aggiunta di calore fa muovere le molecole più velocemente e colpire i lati e il coperchio con maggiore forza, spostando così il coperchio verso l’alto mentre il gas si espande.,
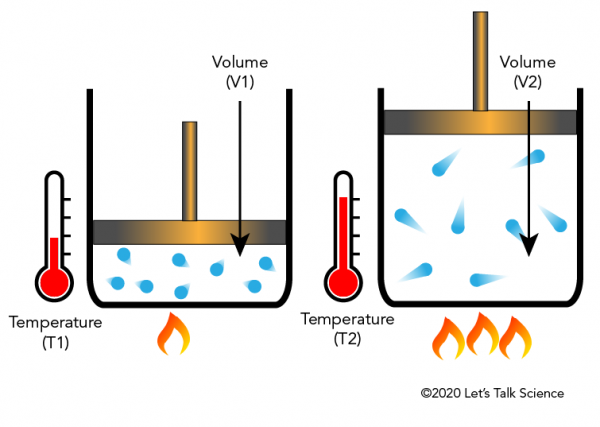
La legge di Charles nella vita quotidiana
Per far salire una mongolfiera, il calore viene aggiunto all’aria all’interno del pallone. L’aggiunta di calore fa sì che le molecole si allontanino l’una dall’altra.

Nel linguaggio quotidiano, diremmo che l’aria all’interno si espande. Quando ciò accade, la densità totale (massa per unità di volume) del pallone e l’aria al suo interno diminuisce. Quando la densità del palloncino diminuisce per essere inferiore alla densità dell’aria esterna, il palloncino aumenta. Al contrario, il volume di un gas si ridurrà se la sua temperatura diminuisce.
Sotto puoi vedere l’azoto liquido che viene versato su un palloncino verde. L’azoto liquido freddo raffredda l’aria all’interno del palloncino., Di conseguenza le molecole di aria rallentano causando la diminuzione del volume del palloncino.

Durante le vacanze, qualcuno che conosci potrebbe aver usato un termometro per tacchino. Un termometro di tacchino è bloccato nel tacchino mentre cuoce e poi si apre quando la carne è cotta abbastanza. Come funziona questo meraviglioso pezzo di tecnologia? Ha a che fare con la legge di Charles, ovviamente!, All’interno del termometro della turchia c’è una piccola quantità di aria. Quando la temperatura aumenta all’interno del tacchino, l’aria all’interno del termometro tacchino si espande. Una volta raggiunto un certo volume, la parte superiore si apre, dicendo allo chef che il tacchino è cotto correttamente.

Legge di Gay-Lussac
Joseph Louis Gay-Lussac era un chimico e fisico francese che scoprì nel 1802 che se si mantiene costante il volume di un gas (ad esempio in un contenitore chiuso) e si applica calore, la pressione del gas aumenterà. Questo perché i gas hanno più energia cinetica, causando loro di colpire le pareti del contenitore con più forza (con conseguente maggiore pressione).
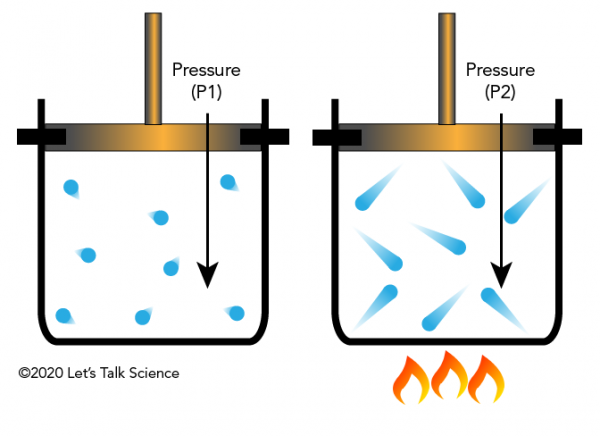
La legge di Gay-Lussac nella vita di tutti i giorni
All’interno di una pentola a pressione il cibo che vuoi cucinare si trova nell’acqua. All’aumentare della temperatura dell’acqua liquida si produce vapore acqueo (acqua allo stato gassoso). Questo vapore non può sfuggire alla pentola a pressione – il che significa che il volume non sta cambiando. La pressione del vapore acqueo continua ad aumentare fino a quando la temperatura dell’acqua e il vapore acqueo superano il normale punto di ebollizione dell’acqua (100 °C). A questa temperatura più elevata il cibo può essere cucinato molto più velocemente., Anche la carne dura esce molto più tenera dopo essere stata cotta in una pentola a pressione.

Lo sapevate che la pressione dell’aria all’interno di pneumatici auto cambia quando la macchina è guidata? Dopo aver guidato, la pressione dell’aria nei pneumatici di un’auto sale. Questo perché l’attrito (una forza di contatto) tra i pneumatici e la strada fa sì che l’aria all’interno dei pneumatici si riscaldi., L’aria non può espandersi perché i pneumatici sono essenzialmente un contenitore a volume fisso, quindi la pressione aumenta – questa è la legge di Gay-Lussac!