Obiettivi formativi
- Conoscere le proprietà fisiche delle sostanze ioniche e molecolari.
Lo stato fisico e le proprietà di un particolare composto dipendono in gran parte dal tipo di legame chimico che visualizza., I composti molecolari, a volte chiamati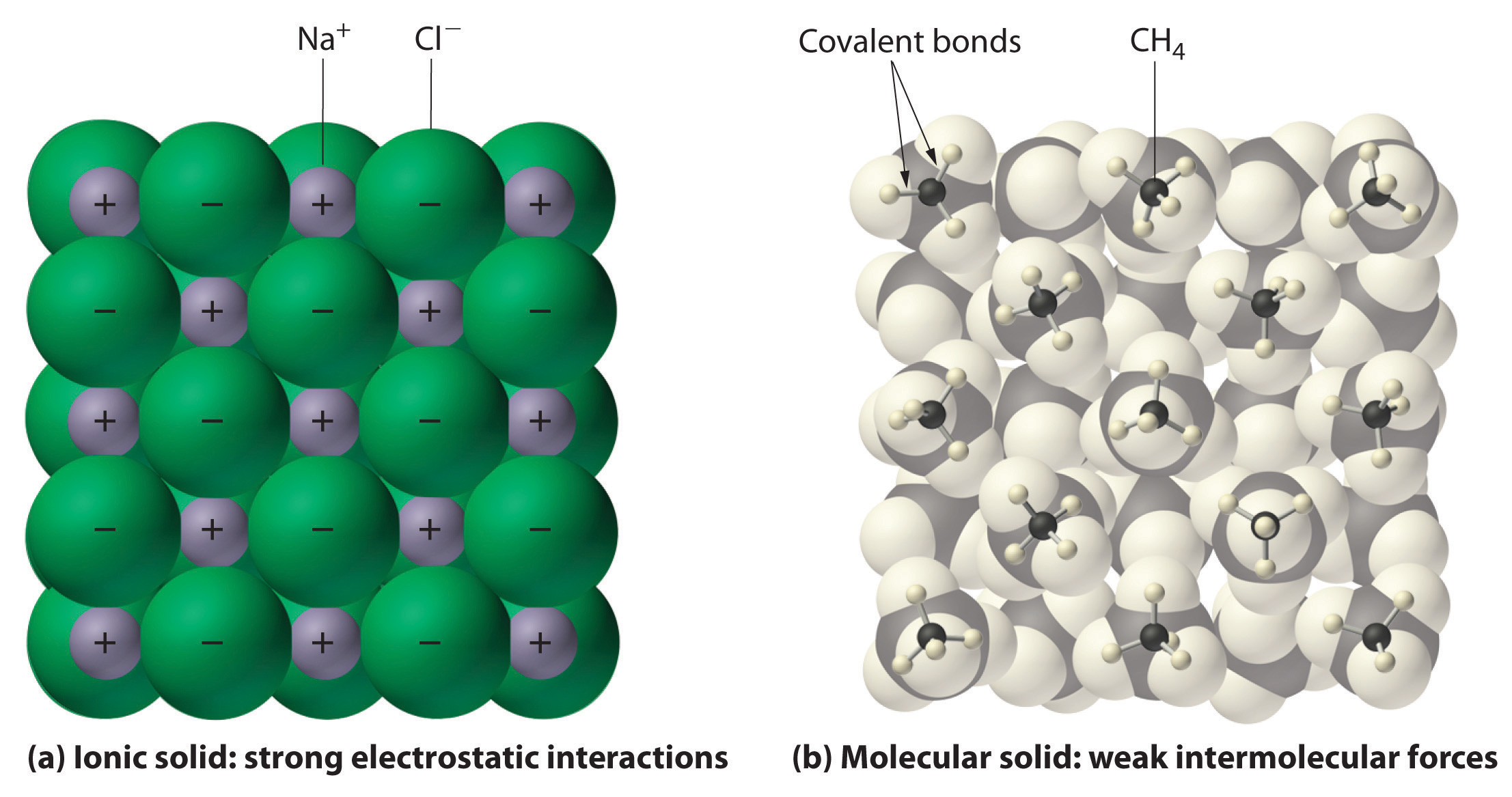 composti covalenti, mostrano una vasta gamma di proprietà fisiche a causa dei diversi tipi di attrazioni intermolecolari come diversi tipi di interazioni polari. I punti di fusione e di ebollizione dei composti molecolari sono generalmente piuttosto bassi rispetto a quelli dei composti ionici. Questo perché l’energia necessaria per interrompere le forze intermolecolari tra le molecole è molto inferiore all’energia necessaria per rompere i legami ionici in un composto ionico cristallino (Figura \(\PageIndex{1}\)) ., I solidi ionici in genere si sciolgono a temperature elevate e bollono a temperature ancora più elevate. Ad esempio, il cloruro di sodio si scioglie a 801 °C e bolle a 1413 °C. (Come confronto, l’acqua del composto molecolare si scioglie a 0 °C e bolle a 100 °C.). La solubilità in acqua dei composti molecolari è variabile e dipende principalmente dal tipo di forze intermolecolari coinvolte.
composti covalenti, mostrano una vasta gamma di proprietà fisiche a causa dei diversi tipi di attrazioni intermolecolari come diversi tipi di interazioni polari. I punti di fusione e di ebollizione dei composti molecolari sono generalmente piuttosto bassi rispetto a quelli dei composti ionici. Questo perché l’energia necessaria per interrompere le forze intermolecolari tra le molecole è molto inferiore all’energia necessaria per rompere i legami ionici in un composto ionico cristallino (Figura \(\PageIndex{1}\)) ., I solidi ionici in genere si sciolgono a temperature elevate e bollono a temperature ancora più elevate. Ad esempio, il cloruro di sodio si scioglie a 801 °C e bolle a 1413 °C. (Come confronto, l’acqua del composto molecolare si scioglie a 0 °C e bolle a 100 °C.). La solubilità in acqua dei composti molecolari è variabile e dipende principalmente dal tipo di forze intermolecolari coinvolte.
Figura \(\PageIndex{1}\) Interazioni nei solidi ionici e covalenti.,
(a) Gli ioni caricati positivamente e negativamente in un solido ionico come
cloruro di sodio (NaCl) sono tenuti insieme da forti interazioni elettrostatiche.
(b) In questa rappresentazione dell’imballaggio di metano (CH4) molecole in massello di metano,
un prototipo molecolare solido, le molecole di metano sono tenuti insieme
in solido solo da relativamente deboli forze intermolecolari, anche se
gli atomi all’interno di ogni molecola di metano sono tenuti insieme da forti legami covalenti.,
Poiché i composti molecolari sono composti da molecole neutre, la loro conduttività elettrica è generalmente piuttosto scarsa, sia allo stato solido che liquido. In forma solida, un composto ionico non è elettricamente conduttivo perché i suoi ioni non sono in grado di fluire (“elettricità” è il flusso di particelle cariche). Quando fuso, tuttavia, può condurre elettricità perché i suoi ioni sono in grado di muoversi liberamente attraverso il liquido (Figura \(\PageIndex{2}\); Video \(\PageIndex{1}\)).,

Figura \(\PageIndex{2}\) Il cloruro di sodio si scioglie a 801 °C e conduce elettricità quando fuso. (credito: modifica del lavoro di Mark Blaser e Matt Evans)
Conducibilità del sale fuso
Video \(\PageIndex{1}\) Guarda questo video per vedere una miscela di sali fondere e condurre l’elettricità.
La tabella seguente riassume alcune delle differenze tra composti ionici e molecolari.,>
solubilità in Acqua
Un tipo di composto molecolare si comporta in modo diverso da quanto descritto finora., Un solido di rete covalente è un composto in cui tutti gli atomi sono collegati tra loro da legami covalenti. Diamante è composto interamente da atomi di carbonio, ciascuno legato ad altri quattro atomi di carbonio in una geometria tetraedrica. La fusione di un solido di rete covalente non si ottiene superando le forze intermolecolari relativamente deboli. Piuttosto, tutti i legami covalenti devono essere rotti, un processo che richiede temperature estremamente elevate. Il diamante, infatti, non si scioglie affatto. Invece, vaporizza in un gas a temperature superiori a \(3500 ^ \ text{o} \ text {C}\).,
Sommario
- Le proprietà fisiche di un materiale sono influenzate dalle forze intermolecolari che tengono insieme le molecole.
- I composti ionici di solito formano solidi cristallini duri con alti punti di fusione. I composti molecolari covalenti, al contrario, sono costituiti da molecole discrete tenute insieme da deboli forze intermolecolari e possono essere gas, liquidi o solidi a temperatura e pressione ambiente.
- I composti ionici in forma fusa o in soluzione possono condurre elettricità mentre i composti molecolari no..,
Collaboratori
-
Marisa Alviar-Agnew (Sacramento City College)
-
Paolo Fiori (Università del North Carolina – Pembroke), Klaus Theopold (Università di Delaware) e Richard Langley (Stephen F. Austin State University), con il contributo degli autori. I contenuti dei libri di testo prodotti da OpenStax College sono rilasciati sotto licenza Creative Commons Attribution License 4.0. Scarica gratuitamente su http://cnx.org/contents/85abf193-2bd…[email protected]).,
-
Fondazione CK-12 di Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson e Jean Dupon.