Catalisi eterogenea
Nella catalisi eterogenea, il catalizzatore è in una fase diversa dai reagenti. Almeno uno dei reagenti interagisce con la superficie solida in un processo fisico chiamato adsorbimento in modo tale che un legame chimico nel reagente diventa debole e poi si rompe. I veleni sono sostanze che si legano irreversibilmente ai catalizzatori, impedendo ai reagenti di adsorbirsi e quindi riducendo o distruggendo l’efficienza del catalizzatore.,
Un esempio di catalisi eterogenea è l’interazione del gas idrogeno con la superficie di un metallo, come Ni, Pd o Pt. Come mostrato nella parte (a) della figura \(\PageIndex{2}\), i legami idrogeno–idrogeno si rompono e producono singoli atomi di idrogeno adsorbiti sulla superficie del metallo. Poiché gli atomi adsorbiti possono muoversi sulla superficie, due atomi di idrogeno possono scontrarsi e formare una molecola di gas idrogeno che può quindi lasciare la superficie nel processo inverso, chiamato desorbimento. Gli atomi H adsorbiti su una superficie metallica sono sostanzialmente più reattivi di una molecola di idrogeno., Poiché il legame H–H relativamente forte (energia di dissociazione = 432 kJ / mol) è già stato rotto, la barriera energetica per la maggior parte delle reazioni di H2 è sostanzialmente inferiore sulla superficie del catalizzatore.
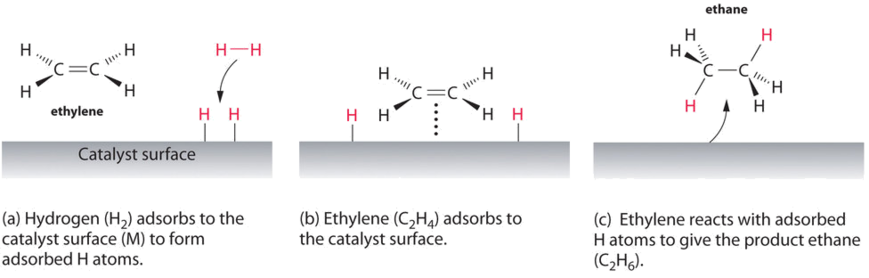
Figura \(\PageIndex{2}\), si evidenzia un processo chiamato idrogenazione, in cui gli atomi di idrogeno vengono aggiunti il doppio legame di un alchene, come l’etilene, per dare un prodotto che contiene C–C singolo obbligazioni, in questo caso etano., L’idrogenazione viene utilizzata nell’industria alimentare per convertire gli oli vegetali, che consistono in lunghe catene di alcheni, in derivati solidi più commercialmente preziosi che contengono catene alchiliche. L’idrogenazione di alcuni dei doppi legami negli oli vegetali polinsaturi, ad esempio, produce margarina, un prodotto con un punto di fusione, una consistenza e altre proprietà fisiche simili a quelle del burro.
Diversi esempi importanti di reazioni catalitiche eterogenee industriali sono nella Tabella \(\PageIndex{1}\)., Sebbene i meccanismi di queste reazioni siano notevolmente più complessi della semplice reazione di idrogenazione qui descritta, tutti implicano l’adsorbimento dei reagenti su una superficie catalitica solida, la reazione chimica delle specie adsorbite (a volte attraverso un certo numero di specie intermedie) e infine il desorbimento dei prodotti dalla superficie.