Atomy a Světelné Energie
studie z atomů a jejich vlastnosti se překrývají několik differentsciences. Chemici, fyzici, a astronomové všichni musí pochopit themicroskopic měřítko, ve kterém velká část vesmíru funguje, aby se vidět „větší obraz“.,
Uvnitř Atomu
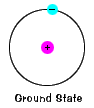 |
základní stav elektronu, úroveň energie, itnormally zabírá, je stav nejnižší energie pro elektron. |
| Tam je také maximální energie, že každý elektron a mohou být stále součástí jeho atom. Kromě této energie již elektron není vázán na jádro atomu a je považován za ionizovaný., | 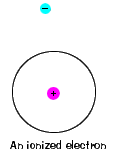 |
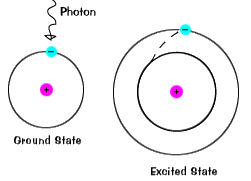 |
Když elektron dočasně zaujímá energetického stavu větší než itsground státu, to je v vzrušeném stavu.Elektron se může stát nadšený, pokud to je vzhledem extra energii, jako když itabsorbs foton, nebo paket světla, nebo se srazí s nedaleké atom nebo částice. |
Světelné Energie
ilustrace na této stránce jsou samozřejmě zjednodušené verze skutečných atomů. Skutečné atomy, dokonce i relativně jednoduché ty,, jako vodík,mají mnoho různých orbitalů, a tak existuje mnoho možných energieswith různé počáteční a konečné stavy., Když je atom v vzrušenémstát, elektron může klesnout až do stavu země najednou, nebo se zastavit na cestě ve střední úrovni.
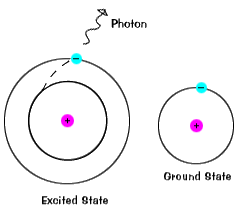 |
Elektrony nemají zůstat v excitovaných stavů velmi dlouho – oni soonreturn jejich zem států, emitující foton s sameenergy jako ten, který byl absorbován., |
Identifikace Jednotlivých Typů Atomů
Přechody mezi různými orbitaly jsou jedinečné pro každý prvek, protože v uvedené úrovně jsou jednoznačně určeny tím, že protony a neutrony v thenucleus. Víme, že různé prvky mají různéprotony a neutrony v jejich jádrech. Když se elektrony určitého atomu vrátí na nižší oběžné dráhyz excitovaných stavů mají fotony, které emitují, energie, které jsoucharakteristické pro tento druh atomu., To dává každému z nich jedinečný otisk prstu, což umožňuje identifikovat prvkypřítomný v kontejneru s plynem nebo dokonce hvězdou.
můžeme použít nástroje, jako je periodická tabulka prvků, abychom přesně zjistili, kolik protonů, a tedy elektronů, má atom. Nejprve víme, že aby atom měl neutrální náboj, musí mít stejný početprotonů a elektronů. Pokud atom ztratí nebo získá elektrony, stane se nebo nabitý. Periodická tabulka nám dá atomové čísloprvek. Atomové číslo nám říká, kolik protonů atomhas., Například vodík má atomové číslo jedna – což znamená, že májeden proton, a tedy jeden elektron-a ve skutečnosti nemá žádné neutrony.
Student
na Základě předchozího popisu atomu, kreslit amodel atomu vodíku. „Standardní“ model atomu je známjako Model Bohr.
Různé formy téhož chemického prvku, které se liší pouze tím, že počet neutronů v jejich jádra se nazývají izotopy. Většina prvků mávíce než jeden přirozeně se vyskytující izotop., Mnoho dalších izotopů bylovyrobené v jaderných reaktorech a vědeckých laboratořích. Izotopy obvykle nejsou příliš stabilní a mají tendenci podléhat radioaktivnímu rozpadu, dokud nevznikne něco stabilnějšího. Možná jste obeznámeni s elementuranium-má několik nestabilních izotopů, U – 235 je jedním z nejvíceběžně známé. 235 znamená, že tato forma uranu má 235 neutronůa protony dohromady. Pokud bychom se podívali na atomové číslo uranu a odčetli ho z 235, mohli bychom vypočítat počet neutronů, které izotop má.,
Zde je další příklad – uhlík se obvykle vyskytuje ve formě C-12 (uhlík-12), který je, 6 protonů a 6 neutronů, i když jeden izotopu C-13, s 6protons a 7 neutronů.
Student
Použití periodické tabulky a názvy prvků uvedených níže, aby zjistit, kolik protonů, neutronů a elektronů, které mají.Nakreslete model atomu následujícího prvku: křemík-28, hořčík-24, síra-32, kyslík-16 a helium-4.,
Student
Pomocí textu, definovat následující pojmy: energetické hladiny, absorpce, emise, vzrušený stav, základní stav, ionizace,atom, prvek, atomová hmotnost, protonové číslo, izotop.
Volitelné Poznámka na Kvantově Mechanické Povahy AtomůZatímco Bohr atom je popsáno výše, je hezký způsob, jak učit o struktuře atomů, to není nejpřesnější způsob, namodel., přestože každý orbital má přesnou energii, teelektron je nyní předpokládán jako rozmazaný v „elektronovém oblaku“ obklopujícím jádro. To je běžné mluvit ze střední vzdálenosti thecloud jako poloměr elektronu na oběžné dráze.Tak nezapomeňte, budeme se držet slova „orbit“ a „orbitální“, i když jsme jsou pomocí nich popsat ploché orbitální rovině, ale aregion, kde elektron má pravděpodobnost. elektrony jsou udržovány v blízkostijádro elektrickou přitažlivostí mezi jádrem a elektrony.,Zachováno tam stejným způsobem, že devět planet zůstává blízko Slunce místo toho, aby se přiblížilo galaxii. Na rozdíl od sluneční soustavy, kde oběžné dráhy všech planetjsou ve stejné rovině, elektrony oběžné dráhy jsou více trojrozměrné. Každá úroveň energie na atomu má jiný tvar. Existují matematické rovnice, které vám řeknou pravděpodobnost umístění elektronu na této oběžné dráze. uvažujme o atomu vodíku,který jsme již nakreslili Bohr model.,
text a obrázky v této sekci byl upraven od Dave Slaven stránku na Atom (viz Odkazy níže). |

