Nucleophilic Substituce Hydroxylové Skupiny
chemické chování alkyl halogenidy mohou být použity jako reference v objevování obdobné substituční a eliminační reakce alkoholů. Hlavním rozdílem je samozřejmě změna zanechávajícího anionu z halogenidu na hydroxid. Protože kyslík je mírně elektronegativnější než chlor (3.5 vs. 2.8 na Paulingovu stupnici), C-O vazba se očekává, že bude více polární než C-Cl vazba., Kromě toho, nezávislá měření elektrofilní vlastnosti uhlíkových atomů od jejich NMR chemické posuny (oba 13C a alfa protony) naznačuje, že kyslík a chlór substituentů vyvíjet podobné elektron-zrušení vlivu, když vázaných na sp3 hybridizované atomy uhlíku. Přes tento slibný důkaz o pozadí, alkoholy nepodléhají stejným SN2 reakcím běžně pozorovaným u alkylhalogenidů. Například rychlá reakce SN2 1-bromobutanu s kyanidem sodným, uvedená níže, nemá žádnou paralelu, když je 1-butanol ošetřen kyanidem sodným., Ve skutečnosti se ethylalkohol často používá jako rozpouštědlo pro substituční reakce alkylhalogenidů, jako je tato.
CH3CH2CH2CH2–Br + Na(+) CN(–)  CH3CH2CH2CH2–CN + Na(+) Br(–)
CH3CH2CH2CH2–CN + Na(+) Br(–)
CH3CH2CH2CH2–OH + Na(+) CN(–)  Žádná Reakce
Žádná Reakce
zde klíčovým faktorem je stabilita odchodu anion (bromid vs. sodný)., HBr je mnohem silnější kyselina než voda (více než 18 řádů), a tento rozdíl se odráží v reakcích, které generují jejich konjugovaných bází. Slabší báze, bromid, je stabilnější a její uvolňování v substituční nebo eliminační reakci je mnohem příznivější než u hydroxidového iontu, silnější a méně stabilní báze.
jasným krokem ke zlepšení reaktivity alkoholů v SN2 reakcích by bylo upravit funkční skupinu –OH způsobem, který zlepšuje její stabilitu jako opouštějící aniont., Jednou z takových modifikací je provedení substituční reakce v silné kyselině, konverze-OH na-OH2 (+). Protože vodíku iontů (H3O(+)) je mnohem silnější kyselina než voda, její konjugovaná báze (H2O) je lepší odstupující skupina, než sodný iont. Jediný problém s touto strategií je, že mnoho nucleophiles, včetně kyanidu, jsou deaktivovány pomocí protonace v silné kyseliny, účinně odstraňování nucleophilic co-reaktant potřebné pro střídání., Silné kyseliny HCl, HBr a HI nepodléhají této obtížnosti, protože jejich konjugované báze jsou dobrými nukleofily a jsou dokonce slabšími bázemi než alkoholy. Následující rovnice ilustrují některé substituční reakce alkoholů, které mohou být těmito kyselinami ovlivněny. Stejně jako u alkylhalogenidů probíhá nukleofilní substituce 1º-alkoholů mechanismem SN2, zatímco 3º-alkoholy reagují mechanismem SN1. Reakce 2º-alkoholů mohou nastat oběma mechanismy a často produkují některé přeskupené produkty., Čísla v závorkách vedle vzorců minerálních kyselin představují hmotnostní procento koncentrovaného vodného roztoku, ve formě, ve které se tyto kyseliny běžně používají.
i když se tyto reakce někdy označují jako“ katalyzované kyselinou“, není to přísně správné. Při celkové transformaci je silná kyselina HX přeměněna na vodu, velmi slabou kyselinu, takže pro úplnou přeměnu alkoholu na alkylhalogenid je zapotřebí alespoň stechiometrické množství HX., Nutnost použití ekvivalentních množství velmi silných kyselin v této reakci omezuje jeho užitečnost na jednoduché alkoholy výše uvedeného typu. Alkoholy s kyselinami citlivými skupinami samozřejmě netolerují takovou léčbu. Nicméně myšlenka úpravy funkční skupiny-OH, aby se zlepšila její stabilita jako opouštějící anion, může být sledována v jiných směrech. Následující schéma ukazuje některé modifikace, které se ukázaly jako účinné. V každém případě se hydroxylová skupina převede na ester silné kyseliny. První dva příklady ukazují dříve popsané sulfonátové estery., Třetí a čtvrtý příklad ukazují tvorbu esteru fosfitu (X představuje zbývající bromy nebo další substituenty alkoholu)a esteru chlorosulfitu. Všechny tyto odcházející skupiny (v modré barvě), konjugované kyseliny, které jsou mnohem silnější než voda (od 13 do 16 mocniny deseti); to znamená, že opuštění anion je odpovídajícím způsobem stabilnější než sodný iont. Sloučeniny mesylátu a tosylátu jsou zvláště užitečné, protože mohou být použity při substitučních reakcích se širokou škálou nukleofilů., Meziproduktů vyrobených v reakcích alkoholů s fosforem tribromide a thionyl chlorid (poslední dva příklady) jsou zřídka izolované, a tyto reakce pokračovat ve výrobě alkyl bromidu a chloridu produkty.
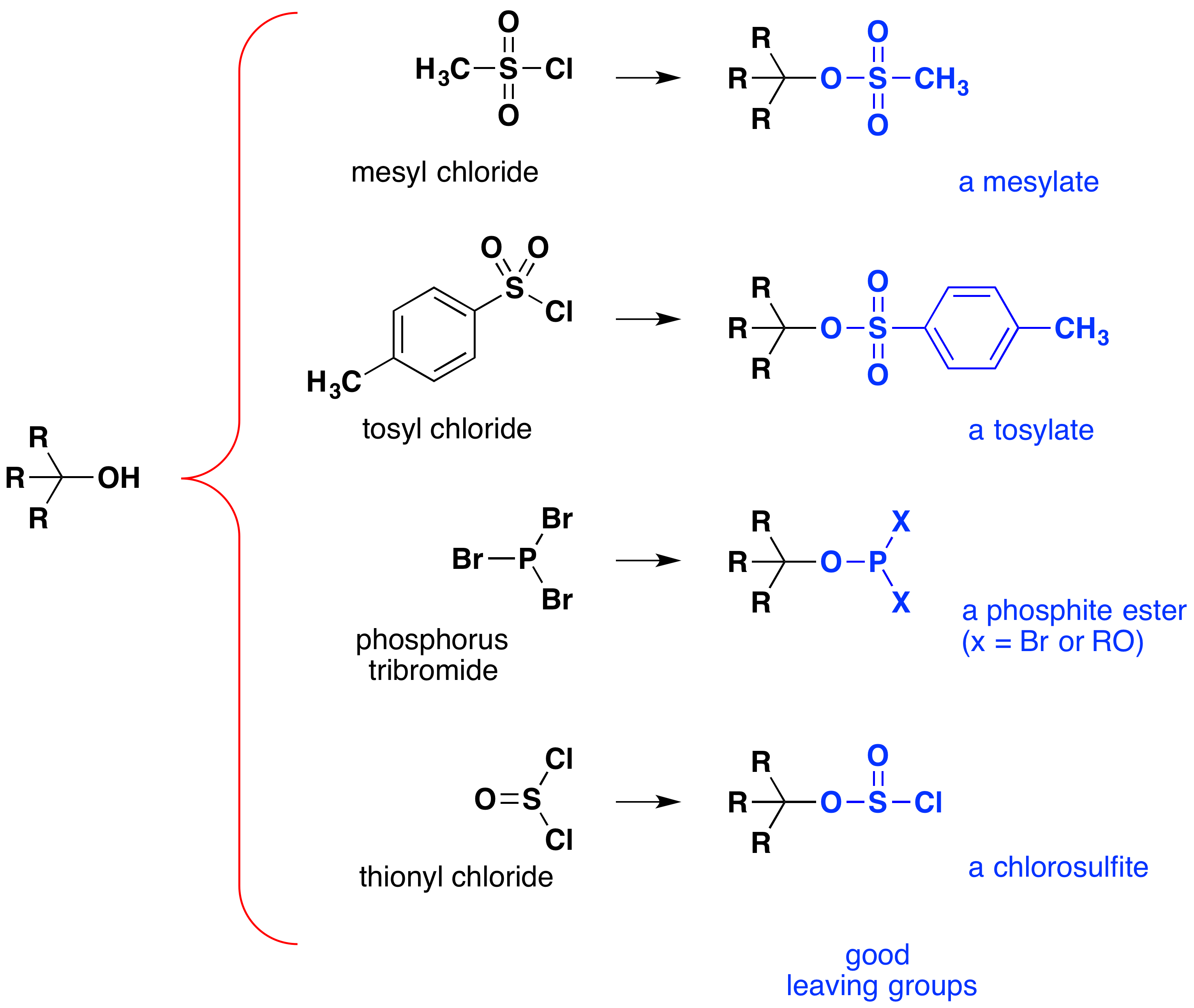
význam sulfonát ester meziproduktů v obecné nucleophilic substitution reakce alkoholů může být ilustruje následující konverze 1-butanolu na pentanenitrile (butyl kyanid), reakce, která se nevyskytuje s alkoholem sám., Fosfor a thionyl halogenidy, na druhou stranu, jednat pouze k převedení alkoholů na odpovídající alkyl halogenidy.,
| CH3CH2CH2CH2–OH + CH3SO2Cl | pyridine
|
CH3CH2CH2CH2–OSO2CH3 | Na(+) CN(–)
|
CH3CH2CH2CH2–CN + CH3SO2O(–) Na(+) |
Some examples of alcohol substitution reactions using this approach to activating the hydroxyl group are shown in the following diagram., První dva případy slouží k posílení skutečnosti, že deriváty sulfonátového esteru alkoholů mohou nahradit alkylhalogenidy v různých reakcích SN2. Další dva případy ukazují použití tribromidu fosforu při přeměně alkoholů na bromidy. Toto činidlo může být použito bez přidané báze (např. pyridinu), protože produkt kyseliny fosforečné je slabší než kyselina HBr. Fosforový tribromid se nejlépe používá s 1º-alkoholy, protože 2º-alkoholy často přinášejí přeskupení vedlejších produktů vyplývajících z konkurenčních SN1 reakcí., Všimněte si, že éterový kyslík v reakci 4 není tímto činidlem ovlivněn, zatímco alternativní syntéza pomocí koncentrovaného HBr štěpí ethery. Chloridu fosforitého (PCl3) převádí alkoholy k alkyl chloridy v podobným způsobem, ale thionyl chloridu sodného je obvykle přednostní pro tuto transformaci, protože anorganické produkty jsou plyny (SO2 & HCl). Fosforový trijodid není stabilní, ale může být generován in situ ze směsi červeného fosforu a jódu a působí na přeměnu alkoholů na alkyljodidy., Poslední příklad ukazuje reakci thionylchloridu s chirálním 2º-alkoholem. Přítomnost organické báze, jako je pyridin, je důležitá, protože poskytuje podstatnou koncentraci chloridových iontů potřebných pro konečnou SN2 reakci chlorosufitového meziproduktu., V nepřítomnosti základny, chlorosufites rozkládají na topení, aby přineslo očekávané alkyl sodný s retencí konfigurace,
Terciární alkoholy jsou běžně používané pro substituční reakce typu diskutovat tady, protože SN1 a E1 reakční cesty jsou dominantní a je obtížné kontrolovat.

význam sulfonát estery jako meziprodukty v mnoha substituční reakce nelze přeceňovat., Důsledný důkaz konfigurační inverze, ke které dochází v místě substituce v reakcích SN2, využívá takové reakce. Příklad takového důkazu je zobrazen níže. Zkratky pro běžněji používané sulfonylové deriváty jsou uvedeny v následující tabulce.
| Sulfonyl Skupiny | CH3SO2– | CH3C6H4SO2– | BrC6H4SO2– | CF3SO2– |
|---|---|---|---|---|
| Jméno & Abbrev., | Mesyl nebo Ms | Tosyl nebo Ts | Brosyl nebo Bs | Trifyl nebo Tf |
Inverze Důkaz

Pro více kompletní diskuze o hydroxylové substituční reakce a popis dalších selektivní metody pro tuto transformaci, Klikněte Zde.
přispěvatelé
- William Reusch, Emeritní profesor (Michigan State u.,), Virtual Textbook of Organic Chemistry