Úvod
V zimě, někdy dermatologové přijímat asymptomatických pacientů, s žádné specifické léze, jiné než, možná, některé post-zánětlivé zabarvení, ale se zoufalou potřebu pomoci. Začnou vyprávět příběh o počtu papuly nebo puchýřky se objeví na kůži po první intenzivní sluneční expozici roku., Spolu s lézí, hrozné svědění začíná a zvyšuje se šíří nemoci, po další expozice slunci, někdy se zhoršuje jakýsi pocit pálení. Nicméně, to lidé jsou model slunce o azyl a nadále užívat slunce po celé léto, čekání na papuly se postupně vybledne a zmizí. Hlavní otázky jsou: jak tomu mohu zabránit? Proč mám tento problém od“ 5 “ let, ale nikdy jsem to předtím neměl?,
Jsme největší pravděpodobností jednání s polymorfní světelné erupce (PLE) a v návaznosti na požadavky našich pacientů, lékařský výzkum se především soustředil na strategie prevence stala v dnešní době velmi uspokojivý. Na druhé straně zůstává druhá a rozhodně méně prozkoumaná otázka nejasná, pokud k této skládačce nebylo přidáno více kusů. Cílem této stručné recenze je obnovit nejnovější pokroky v ple možných mechanismech a nejpoužívanějších protokolech pro prevenci nebo léčbu.
Patofiziologie polymorfní světelné erupce: co je nového?,
PLE je nejčastější fotosenzitivní poruchy, vyznačující se tím, intermitentní erupce non-zjizvení, svědivá vyrážka erytematózní papuly, puchýřky nebo plakety (viz Obrázek 1), které se vyvíjejí během několika hodin ultrafialového záření (UVR) expozice kůže pacienta. Nemoc je závislá na genetické náchylnosti, stejně jako na environmentální složce, jako je typ expozice. Zdá se, že PLE se shlukuje v rodinách: odhaduje se, že prevalence PLE byla 21 a 18% U monozygotických a dizygotických dvojčat (1)., Navíc, pozitivní rodinná anamnéza PLE v příbuzných prvního stupně byla přítomna u 12% postižených twin párů ohledem na 4% nedotčena twin párů (p < 0.0001). Na probandwise konkordance u monozygotních byl lepší než v dizygotic dvojčata párů (0.72 vs. 0.30, v tomto pořadí), které prokazují silný genetický vliv (1). Mnoho genů potenciálního zájmu o patogenezi PLE bylo zkoumáno s obecně nereferujícími výsledky., Pomocí analýzy segregace bylo odhadnuto, že 72% britské populace nese alelu citlivosti na PLE s nízkou penetrací (2).
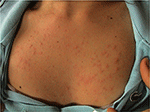
Obrázek 1. Klinický obraz polymorfní erupce světla u mladé ženy.
Selhání Apoptózy: Možné Foto-Indukované Neo Antigeny
V posledních genomu-široký výraz analýzy, pouze 16 geny byly rozdílně vyjádřené mezi PLE a zdravých kontrol po UV ozáření ohledem na kontrolu (3)., Z těchto genů 14 vykazovalo nižší expresi u pacientů s PLE, zatímco dva vedly k nadměrné expresi. Mezi 14 geny s nižší expresí v PLE jsou: doplnit 1s podjednotky (C1s), scavenger receptor B1 (SCARB1) fibronektin (FN1), imunoglobulin nadčeleď člen 3 (IGSF3), kaspázy-1 (CASP1) a paraoxonase 2 (PON2), všechny geny spojené s apoptotických buněk odbavení. Předpokládá se, že modifikace proteinu během apoptotické buněčné clearance by mohla vést k potenciální tvorbě auto-antigenu (4)., Pak snížená exprese v PLE pacientů genů připojené k tomuto procesu by mohla představovat možné auto-antigenu zdroj, stejně jako zásadní fázi při zahájení autoimunitní proces, který podporuje onemocnění (3). V souladu s těmito zjištěními, Kuhn et al. vykazovala akumulaci apoptotických buněk u pacientů s PLE ozářených buď 1, 5 minimální dávkou erytému (MED) UVB, nebo 60-100 J/cm2 UVA1 ve srovnání s kontrolami (5).,
Imunita: Tolerance Selhání
Auto-antigeny, které vyplývají z neefektivní clearance apoptotických buněk, jsou pravděpodobně převzat dendritické buňky (DCs) a prezentovány na naivní T-lymfocyty (cytotoxické a pomocné) poté transformována v auto-reaktivní T buňky (6, 7). Toto částečné selhání apoptózy přispívá spolu s nedostatečnou imunosupresí po expozici UV záření k rozpoznávání a prezentaci antigenu, což vede k klinickému projevu typickému pro pacienty s PLE (8)., Neschopnost normální UVR indukované imunosuprese bylo prokázáno jako hlavní imunologické abnormality v PLE, vysvětlil, zpočátku, trvalost Langerhansových buněk (LCs) v epidermis. Tato nadměrná aktivace imunitního systému, která uniká funkční toleranci vyvolané UV zářením, je pravděpodobně zodpovědná za sníženou prevalenci rakoviny kůže u pacientů s PLE (9). Na druhé straně je stejný mechanismus vinen za selhání potlačení alergické kontaktní dermatitidy (ACD) po expozici UVR (10).,
Zánětlivé Cesty: Přecitlivělost oddáleného Typu Reakce
imunologické mechanismy zapojené v PLE, s mediátory z vrozený a adaptivní imunitní systém, jsou velmi podobné, a to buď z histologické nebo biochemické hlediska, ACD ty. Na počátku sedmdesátých let Epstein poprvé indikoval PLE jako reakci přecitlivělosti zpožděného typu (DTHR) na nedefinovaný kožní antigen indukovaný UVR (11). Nedávno, k posílení tohoto konceptu, byly některé zánětlivé mediátory zapojené do ACD demonstrovány také v PLE., Například, IL-1 rodiny (12, 13), rostoucí skupiny cytokinů, které hrají několik rolí v imunitní regulaci a zánětu (14), podílí se také na patogenezi ACD (12, 15), byla prozkoumána také v PLE (16). IL-36α a IL-36γ, pro-zánětlivé členů z IL-1 rodiny byly zvýšeny v PLE ohledem na ovládání, jak pro ACD vzorky, ale IL-36γ byl hodně rozšířen v PLE než v ACD (16). Jednající prostřednictvím společné receptor složený z IL-36R a IL-1R/Akt (IL-1RL2), IL-36α, IL-36β, a IL-36γ aktivaci NF-kB a MAPKs, podpora zánětlivé reakce., Zvýšení IL-36 v kůži a periferní krve PLE pacientů indikuje aktivaci lokální a systémové imunitní odpovědi, jak bylo zjištěno v mnoha zánětlivých onemocnění kůže (15, 17, 18). Pravděpodobně spojení mezi il-36S a UVR expozicí představuje parakrinní prozánětlivý signál aktivace Toll like receptor (TLR)-3 v důsledku uvolňování RNA nekrotickými keratinocyty (19). Selhání apoptotické clearance v PLE, s množstvím buněčných zbytků, by mohlo být zodpovědné za zesílení tohoto „výstražného signálu.,“
kromě toho, IL-36s by mohly přispět k zesílení vrozený imunitní signálu a následné zánětlivé kaskády, podpora antimikrobiální peptidy (AMPs) (20).
Zánětlivé Cesty: Zesilovače a Mikrobiomu
Jako do značné míry zkoumány v několika kožních zánětlivých procesů, tyto mediátory, pojmenované jako defensiny (α a β), cathelicidin (LL37), ribonuclease 7 (RNase7) a psoriasin (S100A7), v světle nerovnováhy vyvolané UVR na keratinocyty a kůže mikrobiomu, byly také zkoumány v PLE (21, 22). Patra et al., zjistili, že exprese psoriasinu, RNase7, HBD-2 A LL-37 byla zvýšena u PLE lesional skin, zatímco HBD-3 byl snížen. Vzhledem k tomu, že povrch kůže jako „multietnický svět“, aniž bychom zapomněli na klíčovou roli keratinocytů, nemůžeme vyloučit, že uvolňování zesilovačů by mohlo být určeno modifikací mikrobiomových složek po UV interakci (23). Mikrobiom by skutečně mohl představovat zdroj, přímý nebo nepřímý, dosud nezjištěných antigenů indukovaných UVR vytvořených u pacientů s PLE, což by vedlo k poškození keratinocytů., V důsledku toho by LL-37, také indukovaný UVB, IFNy, TNF-α, IL-6, mohl představovat potenciální nepřímý ovladač PLE (23). To může tvořit agregáty s self-nukleové kyseliny schopen aktivovat pdc: u psoriázy byla uznána jako hlavní autoantigen (24). Přestože u pacientů s PLE byla hlášena úplná absence PDC (25), existuje autoimunitní prostředí a LL-37 by mohl hrát klíčovou roli, což by vyvolalo další zánětlivé cesty. Na obrázku S1 (doplňkový materiál) jsou výše uvedené pojmy vizualizovány v karikatuře.
terapie polymorfní světelné erupce: co je nového?,
první linie léčby PLE zahrnuje vyhýbání se slunci, opalovací krémy a lokální kortikosteroidy (26). Pro všechny pacienty preventivní řízení je zásadní během slunečného počasí, vyhýbání se intenzivní UVR expozice a používání ochranných oděvů, stejně jako použití opalovací krém, a to zejména během první expozice roku. Nová generace širokospektrální ochranu proti slunečnímu záření s vysokým ochranným faktorem UVB (SPF), spolu s delší vlnové délky UVA ochranu, byly hlášeny udělit úplnou nebo částečnou ochranu až 90% PLE pacientů (27, 28)., Použití perorálních antioxidantů a nikotinamidu by mohlo představovat další platné preventivní opatření pro tyto pacienty. Blahodárné účinky nikotinamid byly zkoumány v nekontrolované studie 42 pacientů, kde 60% z nich uvedlo úplné zrušení příznaky při užívání 2-3 g nikotinamidu denně, před sluněním (29). Kromě toho bylo prokázáno, že extrakt tropického kapradinového Polypodiumleucotomos [PL) vykazuje jak silné antioxidační, tak imunomodulační účinky., Při podávání 480 mg / den před slunečním zářením výrazně snížila kožní reakce a subjektivní příznaky (30, 31). Pokud jde o topický kortikosteroid, i když nebyly provedeny žádné studie k určení jejich účinnosti v PLE, jsou široce používány ke snížení svědění (26). Druhá řada léčby PLE zahrnuje systémové kortikosteroidy a terapii fotografií(chemo) (26). V randomizované, dvojitě zaslepené, placebem kontrolované studii (32) autoři navrhli použít 25 mg prednisolonu denně po dobu 4-5 dnů na počátku erupce., I když, potenciální dlouhodobé vedlejší účinky opakované kurzy prednisolon, musí být považovány za, to může být doporučena pro pacienty, kteří trpí občasnými záchvaty PLE, při absenci jakýchkoliv kontraindikací. V mírnějších případech PLE může postačovat samoklimatizační program absolventským vystavením slunečnímu záření na jaře (33). Zatímco v závažnějších případech může být vhodnější léčba pod lékařským dohledem/desenzibilizací., Průběh léčby psoralen a UVA (PUVA), narrowband (NB)-UVB nebo širokopásmová (BB)-UVB fototerapie, obvykle podávaná brzy na jaře, může být účinná i profylaktická léčba (26). Léčebný protokol se obvykle skládá z jednoho průběhu fototerapie / fotochemoterapie po dobu 5-6 týdnů. Počáteční dávky závisí na minimální erytémové dávky (MED) nebo minimální fototoxická dávka (MPD), a jsou často 50-70% těchto naměřených prahů s kumulativní zvyšuje., Pro udržení přínosu získaného při desenzibilizační terapii se doporučuje pravidelné vystavení slunci po celé léto, jinak by mohlo dojít ke ztrátě kalení během 4-6 týdnů. V léčbě PLE, NB-UVB by měly být upřednostňovány na PUVA (síla doporučení D; důkazní úroveň 4), protože nižší riziko photocarcinogenesis, žádné riziko nevolnosti nebo jiné vedlejší účinky spojené s požitím MOP, a to bez nutnosti použití po léčbě ochranu očí. PUVA by však měla být zvážena před jinými systémovými léčbami, pokud NB-UVB selhala nebo dříve spustila erupci., Ve skutečnosti, jak je popsáno níže, účinnost byla prokázána pro více fototerapie režimů (BB-UVB, NB-UVB a PUVA), a vedlejší účinky, v období vyrážka provokace, erytém a svědění bylo zjištěno, že více společného s UVB než s PUVA (34). Jak je shrnuto, v literatuře má účinnost PUVA za následek rychlost fotoprotekce 65-100% (34)., Více srovnávací studie byly provedeny, ale z jediné randomizované kontrolované studii mezi PUVA a NB-UVB plus placebo tablety, třikrát týdně, po dobu 5 týdnů, žádný významný rozdíl v účinnosti se objevily, vzhledem k tomu, výskyt PLE nebo venkovní aktivity, omezení (35). V 10 let retrospektivní recenze, hlášeno Man et al. (36), 170 pacientů se středně těžkou až těžkou PLE dostalo PUVA a/nebo UVB fototerapii. V následujícím roce dostalo PUVA 8 pacientů PUVA, 128 NB-UVB, 5 BB-UVB a 29 pacientů, kteří uspokojivě nereagovali na NB-UVB., Byly provedeny vlastní hodnocení závažnosti a frekvence epizod PLE byla hlášena při následných návštěvách na podzim nebo během následujícího jara. Dobré nebo mírné zlepšení bylo hlášeno u 88% pacientů léčených PUVA a u 89% pacientů, kteří dostávali UVB. Z pacientů léčených PUVA i NB-UVB většina upřednostňovala PUVA. V dalších 14-let retrospektivní studie na 79 pacientů léčených fototerapií (37), účinnost, měřená během následujícího léta v období fotoprotekce s kompletní/parciální remise, byl 65% pro PUVA, 82% pro BB-UVB a 83% UVA sám., V tomto případě byla léčba PUVA vyhrazena pro závažnější formy PLE.
mechanismy, kterými fototerapie indukuje fotoprotekci, nejsou plně pochopeny.
v posledních letech však bylo provedeno mnoho pokroků. Kromě známých účinků na melaninizaci a epidermální zesílení fototerapie je hlášeno široké spektrum imunomodulačních a protizánětlivých vlastností indukovaných UV zářením (38)., UVB a UVA modulovat adhezní molekuly projevu a vyvolat rozpustné mediátory, jako jsou a-melanocyty-stimulující hormon, IL-10 (což potlačuje produkci interferonu γ) a prostaglandinu E2, který vysvětlete anti-pobuřující akce, brání T-buněk, aktivace a podpora apoptózy kůže infiltrací T-buněk (34). Navíc, bylo prokázáno, že profylaktická UV photohardening v PLE pacientů obnovuje UV-indukované LC migrace z epidermis na kůži-vyprázdnění lymfatických uzlin: jedním z klíčových buněčné události v UV-imunosuprese (39)., Tolerance indukovaná LC je zprostředkována uvolněním imunosupresivního cytokinu, jako je IL-10, a interferencí s dozráváním a indukcí regulačních T buněk (Tregs) (40). Navíc nedávno bylo hlášeno zajímavé spojení mezi LC, Tregs a vitamínem D3. Bylo skutečně prokázáno, že krátkodobá 1 týdenní topická Předúprava s analogem 1,25-dihydroxyvitaminu D, kalcipotriolem, snížila příznaky PLE po následné experimentální fotoprovokaci (41)., Kromě toho ve studii s myší 1,25-dihydroxyvitamin D vykazoval srovnatelné imunosupresivní účinky jako UV (42). Mezi LC a žírnými buňkami byl zvýrazněn další zajímavý přechod. Kromě jejich uznávané roli v atopie, kožní žírné buňky jsou také zodpovědné pro ochranu pleti před UVB indukované zánět, podporovat UV záření, imunosuprese (40). Lidské studie prokázaly, že po akutní a chronické expozici UVR se zvyšuje počet dermálních žírných buněk spolu s uvolněním IL-10., Celkově tyto údaje naznačují potenciální roli žírných buněk v PLE a v mechanismu fotohardeningu. V souladu s tím, Wolf et al. poprvé uvedli, že fotohardening významně zvyšuje hustotu žírných buněk v papilární dermis pacientů s PLE (40). Shrnutí, fotohardening funguje v PLE obnovením normální UV imunitní supresivní dráhy, zahrnující více typů buněk. Léčba třetí linie pro PLE zahrnuje použití systémových imunosupresivních léků, jako je azathioprin a cyklosporin., V literatuře jsou však hlášeny pouze sporadické případy úspěšně léčených pacientů (43, 44). Kromě toho byly jako léčba navrženy hydroxychlorochin, omega-3 mastné kyseliny a beta-karoten, ale jsou vyžadovány další dvojitě zaslepené randomizované kontrolované studie, které skutečně posoudí jejich klinickou účinnost.
Závěry
Vzhledem k vysoké prevalence a zvyšující se výskyt PLE, spojené nepohodlí a životní styl omezení, budoucí studie jsou nutné k nalezení nových terapeutických a/nebo preventivní strategie., Výběr vhodné léčby PLE vyžaduje dobrou znalost individuálního klinického průběhu onemocnění spolu s možností provedení fototestu. Byly zdůrazněny některé nové aspekty možné aktivace a propagace zánětlivého procesu.,
současný stav znalostí, a to navzdory identifikace některých klíčových buněčných nařízení podílející se na obnově imunitní tolerance, je obtížné vyvozovat definitivní závěry o účinnosti různých potenciál léčby v PLE, kvůli nedostatku adekvátní studie a obtížnost při hodnocení výsledku opatření. Klinické skóre pro posouzení závažnosti PLE (PLESI) (45) zůstává nástrojem, který se používá jen stěží a hlavně je omezen na výzkumné účely., Hlubší studium základních patogenetických mechanismů poruchy umožní cílenější přístup k léčbě.
autorské příspěvky
SL promítl rukopis, vybral materiál pro papír, napsal Počáteční návrh a opravil následující návrhy rukopisu. AR se zabýval psaním rukopisu a podporoval nové myšlenky obsahu a stylu.,
Prohlášení o střetu zájmů
autoři prohlašují, že výzkum byl proveden bez jakýchkoli obchodních nebo finančních vztahů, které by mohly být chápány jako potenciální střet zájmů.
doplňkový materiál
obrázek S1. Souhra mezi vrozeným a adaptivním imunitním systémem v souvislosti se selháním apoptózy v epidermis. (Zelený symbol) Psoriasin: hojný výraz v spinózních a zrnitých vrstvách kůže PLE. (Modrý symbol) RNase7: vyjádřeno hlavně v keratinocytech stratum granulosum a stratum corneum lézí PLE., (Žlutý symbol) LL-37 byl hluboce vyjádřen v krevních cévách a žlázách v PLE a kolem nich. Apoptotické keratinocyty s neefektivní clearance.,hic light eruption; ACD, Allergic contact dermatitis; DTHR, Delayed type hypersensitivity reaction; UVR, Ultraviolet radiation; C1s, Complement 1s subunit; SCARB1, Scavenger receptor B1; FN1, Fibronectin; IGSF3, Immunoglobulin superfamily member 3; CASP1, Caspase-1; PON2, Paraoxonase 2; MED, Minimal Erythema Dose; DCs, Dendritic cells; LCs, Langerhans cells; TLR, Toll like receptor; AMPs, Antimicrobial peptides; SPF, Sun protection factor; PUVA, Psoralen and UVA therapy; NB-UVB, Narrowband; BB-UVB, Broadband UVB; MPD, Minimum phototoxic dose; Tregs, Regulatory T cells; PL, Polypodiumleucotomos.,
2. McGregor JM, Grabczynska S, Vaughan R, Hawk JL, Lewis CM. Genetic modelling of abnormal photosensitivity in families with polymorphic light eruption and actinic prurigo. J Invest Dermatol. (2000) 115:471–6. doi: 10.1046/j.1523-1747.2000.00080.x
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Lembo S, Hawk JLM, Murphy GM, Kaneko K, Young AR, McGregor JM, et al., Aberrant gene expression with deficient apoptotic keratinocyte clearance may predispose to polymorphic light eruption. Br J Dermatol. (2017) 177:1450–3. doi: 10.1111/bjd.15200
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Savill J, Fadok V. Corpse clearance defines the meaning of cell death. Nature (2000) 407:784–8. doi: 10.,1038/35037722
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Kuhn A, Herrmann M, Kleber S, Beckmann-Welle M, Fehsel K, Martin-Villalba A, et al. Accumulation of apoptotic cells in the epidermis of patients with cutaneous lupus erythematosus after ultraviolet irradiation. Arthritis Rheum. (2006) 54:939–50. doi: 10.1002/art.21658
PubMed Abstract | CrossRef Full Text | Google Scholar
6., Savill J, Dransfield I, Gregory C, Haslett C. A blast from the past: clearance of apoptotic cells regulates immune responses. Nat RevImmunol. (2002) 2:965–75. doi: 10.1038/nri957
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Albert ML, Sauter B, Bhardwaj N. Dendritic cells acquire antigen from apoptotic cells and induce class I-restricted CTLs. Nature (1998) 392:86–9. doi: 10.,1038/32183
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Koulu LM, Laihia JK, Peltoniemi HH, Jansén CT. UV-induced tolerance to a contact allergen is impaired in polymorphic light eruption. J Invest Dermatol. (2010) 130:2578–82. doi: 10.1038/jid.2010.181
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Epstein JH. Polymorphous light eruption. J Am Acad Dermatol. (1980) 3:329–43.,
PubMed Abstract | Google Scholar
12. Mattii M, Ayala F, Balato N, Filotico R, Lembo S, Schiattarella M, et al. The balance between pro- and anti-inflammatory cytokines is crucial in human allergic contact dermatitis pathogenesis: the role of IL-1 family members. Exp Dermatol. (2013) 22:813–9. doi: 10.1111/exd.12272
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Dinarello CA., Interleukin-1 v patogenezi a léčbě zánětlivých onemocnění. Krev (2011) 117: 3720-32. doi: 10.1182/krev-2010-07-273417
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
16. Lembo S, Caiazzo G, Balato N, Monfrecola G, Patra v, Wolf P, et al. Polymorfní erupce světla a členové rodiny IL-1: jakýkoli rozdíl s alergickou kontaktní dermatitidou? Fotochem Fotobiol Sci. (2017) 16:1471–9. doi: 10.,1039/c7pp00142h
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Balato A, Schiattarella M, Lembo S, Mattii M, Prevete N, Balato N, et al. Interleukin-1 family members are enhanced in psoriasis and suppressed by vitamin D and retinoic acid. Arch Dermatol Res. (2013) 305:255–62. doi: 10.1007/s00403-013-1327-8
PubMed Abstract | CrossRef Full Text | Google Scholar
19., Borkowski AW, Kuo IH, Bernard JJ, Yoshida T, Williams MR, Hung NJ. Aktivace mýtného receptoru 3 je nutná pro normální opravu kožní bariéry po poškození UV zářením. J. Invest Dermatol. (2015) 135:569–78. doi: 10.1038/jid.2014.354
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
20. Li N, Yamasaki k, Saito R, Fukushi-Takahashi S, Shimada-Omori R, Asano M, et al. Alarminová funkce katelicidinového antimikrobiálního peptidu LL37 prostřednictvím indukce IL-36γ v lidských epidermálních keratinocytech. J., (2014) 193:5140–8. doi: 10.4049/jimmunol.1302574
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Patra V, Wolf P. Microbial elements as the initial triggers in the pathogenesis of polymorphic light eruption? Exp Dermatol. (2016) 25:999–1001. doi: 10.1111/exd.13162
PubMed Abstract | CrossRef Full Text | Google Scholar
22., Gläser R, Navid F, Schuller W, Jantschitsch C, Harder J, Schröder JM, et al. UV-B záření indukuje expresi antimikrobiálních peptidů v lidských keratinocytech in vitro a in vivo. J Alergie Clin Imunol. (2009) 123:1117–23. doi: 10.1016 / j. jaci.2009.01.043
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
23. Patra V, Mayer G, Gruber-Wackernagel A, Horn M, Lembo S, Wolf P., Unikátní profil antimikrobiální peptidové exprese v polymorfních lézích erupce světla ve srovnání se zdravou kůží, atopickou dermatitidou a psoriázou. Fotodermatol Photoimunol Photomed. (2018) 34:137–44. doi: 10.1111 / phpp.12355
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
25. Schweintzger NA, Gruber-Wackernagel, Shirsath N, Quehenberger F, Obermayer-Pietsch B, Vlk, P. Vliv ročních období na hladiny vitamínu D a T regulačních buněk u pacientů s polymorfní světelná erupce., Photochem Photobiol Sci. (2016) 15:440–6. doi: 10.1039/c5pp00398a
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Proby C, Baker C, Morton O, Hawk JLM. New broad spectrum sunscreen for polymorphic light eruption. Lancet (1993) 341:1347–8.
PubMed Abstract | Google Scholar
28. Allas S, Lui H, Moyal D, Bissonnette R., Srovnání schopnosti 2 opalovacích krémů chránit před polymorfní erupcí světla vyvolanou UV-a/UV-B halogenidovou lampou. Arch Dermatol. (1999) 135:1421–2.
PubMed Abstraktní | Google Scholar
29. Ortel B, Wechdorn D, Tanew A, Honigsmann h. účinek nikotinamidu na fototestní reakci v polymorfní lighterupci. Br J Dermatol. (1988) 118:669–73.
PubMed Abstraktní | Google Scholar
30., Caccialanza M, Percivalle S, Piccinno R, Brambilla R. Photoprotective activity of oral Polypodiumleucotomos extract in 25 patients with idiopathic photodermatoses. Photodermatol Photoimmunol Photomed. (2007) 23:46–7. doi: 10.1111/j.1600-0781.2007.00274.x
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Tanew A, Radakovic S, Gonzalez S, Venturini M, Calzavara-Pinton P. Oral administration of a hydrophilic extract of Polypodiumleucotomos for the prevention of polymorphic light eruption., J Am Acad Dermatol. (2012) 66:58–62. doi: 10.1016/j.jaad.2010.09.773
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Van Praag MCG Boom, BW, Vermeer BJ. Diagnosis and treatment of polymorphous light eruption. Int J Dermatol. (1994) 33:233–9.
Google Scholar
34. Ling TC, Clayton TH, Crawley J, Exton LS, Goulden V, Ibbotson S, et al., Britské asociace dermatologů a britské photodermatology skupiny pokynů pro bezpečné a efektivní použití psoralen ultrafialové terapii 2015. Br J Dermatol. (2016) 174:24–55. doi: 10.1111/bjd.14317
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
36. Man I, Dawe RS, Ferguson J. umělé kalení pro polymorfní světelnou erupci: praktické body z desetileté zkušenosti. Fotodermatol Photoimunol Photomed. (1999) 15:3–4.,
PubMed Abstract | Google Scholar
37. Mastalier U, Kerl H, Wolf P. Clinical laboratory, phototest and phototherapy findings in polymorphic light eruptions: a retrospective study of 133 patients. Eur J Dermatol. (1998) 8:554–9.
PubMed Abstract | Google Scholar
38. Krutmann J, Morita A. Mechanisms of ultraviolet (UV) B and UVA phototherapy. J Invest Dermatol Symp Proc. (1999) 4:70–2.,
PubMed Abstract | Google Scholar
39. Janssens AS, Pavel S, Out-Luiting JJ, Willemze R, de Gruijl FR. Normalized ultraviolet (UV) induction of Langerhans cell depletion and neutrophil infiltrates after artificial UVB hardening of patients with polymorphic light eruption. Br J Dermatol. (2005) 152:1268–74. doi: 10.1111/j.1365-2133.2005.06690.x
PubMed Abstract | CrossRef Full Text | Google Scholar
40., Wolf P, Gruber-Wackernagel A, Bambach i, Schmidbauer U, Mayer G, Absenger M, et al. Fotohardening polymorfních pacientů s erupcí světla snižuje základní epidermální hustotu Langerhansových buněk a zároveň zvyšuje počet žírných buněk v papilární dermis. Exp Dermatol. (2014) 23:428–30. doi: 10.1111 / exd.12427
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
42. Schwarz a, Navid F, Sparwasser T, Clausen BE, Schwarz T., 1,25-dihydroxyvitamin D exerts similar immunosuppressive effects as UVR but is dispensable for local UVR-induced immunosuppression. J Invest Dermatol. (2012) 132, 2762–9. doi: 10.1038/jid.2012.238
PubMed Abstract | CrossRef Full Text | Google Scholar
43. Norris PG, Hawk JL. Successful treatment of severe polymorphous light eruption with azathioprine. Arch Dermatol. (1989) 125:1377–9.
PubMed Abstract | Google Scholar