stručné shrnutí Haberův Proces.
Haberův Proces kombinuje dusíku ze vzduchu s vodíkem odvozeny především ze zemního plynu (metanu) na amoniak. Reakce je reverzibilní a produkce amoniaku je exotermická.,
![]()
![]()
flow systém pro Haberův Proces vypadá takto:
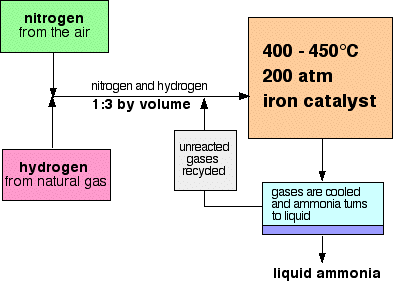
několik poznámek na podmínky,
katalyzátor,
katalyzátor je ve skutečnosti o něco složitější, než čisté železo. Má hydroxid draselný přidaný jako promotor-látka, která zvyšuje jeho účinnost.
tlak
tlak se mění z jednoho výrobního závodu na druhý, ale je vždy vysoký. Nemůžete jít daleko špatně při zkoušce citující 200 atmosfér.,
recyklace
při každém průchodu plynů reaktorem se pouze asi 15% dusíku a vodíku převádí na amoniak. (Toto číslo se také liší od rostliny k rostlině.) Neustálou recyklací nezreagovaného dusíku a vodíku je celková konverze asi 98%.
Vysvětlit podmínky
rozměry dusíku a vodíku,
směs dusíku a vodíku do reaktoru v poměru 1 objem dusíku se 3 objemy vodíku.,
Avogadroův zákon říká, že stejné objemy plynů při stejné teplotě a tlaku obsahují stejný počet molekul. To znamená, že plyny jdou do reaktoru v poměru 1 molekuly dusíku k 3 vodíku.
to je poměr požadovaný rovnicí.
v některých reakcích se můžete rozhodnout použít přebytek jedné z reaktantů. Udělali byste to, pokud je obzvláště důležité spotřebovat co nejvíce druhého reaktantu-pokud by to bylo například mnohem dražší. To v tomto případě neplatí.,
vždy existuje strana dolů, která používá něco jiného než proporce rovnice. Pokud máte nadbytek jednoho reaktantu, budou molekuly procházející reaktorem, které nemohou reagovat, protože pro ně není nic, s čím by reagovaly. Odpadní prostor reaktoru-zejména prostor na povrchu katalyzátoru.
teplota
rovnovážné úvahy
musíte posunout polohu rovnováhy co nejdále doprava, abyste vytvořili maximální možné množství amoniaku v rovnovážné směsi.,
dopředná reakce (produkce amoniaku) je exotermická.
![]()
![]()
Podle Le chatelierův Princip, to bude pravděpodobný pokud je teplota nižší. Systém bude reagovat posunutím polohy rovnováhy, aby tomu zabránil-jinými slovy tím, že vytvoří více tepla.
abyste získali co nejvíce amoniaku v rovnovážné směsi, potřebujete co nejnižší teplotu. 400-450°C však není nízká teplota!,
úvahy o rychlosti
čím nižší je teplota, tím pomalejší je reakce. Výrobce se snaží vyrábět co nejvíce amoniaku denně. Nemá smysl snažit se dosáhnout rovnovážné směsi, která obsahuje velmi vysoký podíl amoniaku, pokud trvá několik let, než reakce dosáhne této rovnováhy.
potřebujete plyny k dosažení rovnováhy ve velmi krátké době, kdy budou v kontaktu s katalyzátorem v reaktoru.,
kompromis,
400 – 450°C je kompromis teploty produkuje poměrně vysoký podíl amoniaku v rovnovážné směsi (i když je to jen 15%), ale ve velmi krátké době.
tlak
Rovnováha úvahy,
![]()
![]()
Všimněte si, že tam jsou 4 molekuly, na levé straně rovnice, ale pouze 2 na pravé straně.,
podle Le Chatelierova principu, pokud zvýšíte tlak, systém bude reagovat upřednostněním reakce, která produkuje méně molekul. To způsobí, že tlak opět klesne.
abyste získali co nejvíce amoniaku v rovnovážné směsi, potřebujete co nejvyšší tlak. 200 atmosfér je vysoký tlak, ale není úžasně vysoký.
úvahy o rychlosti
zvýšení tlaku přivádí molekuly blíže k sobě., V tomto konkrétním případě zvýší jejich šance na zasažení a přilepení na povrch katalyzátoru, kde mohou reagovat. Čím vyšší je tlak, tím lépe, pokud jde o rychlost reakce plynu.
ekonomické úvahy
velmi vysoké tlaky jsou velmi drahé na výrobu ve dvou počtech.
musíte postavit extrémně silné trubky a kontejnmentové nádoby, aby odolaly velmi vysokému tlaku. To zvyšuje vaše kapitálové náklady, když je závod postaven.
vysoké tlaky stojí hodně na výrobu a údržbu., To znamená, že provozní náklady vašeho závodu jsou velmi vysoké.
kompromis
200 atmosfér je kompromisní tlak zvolený z ekonomických důvodů. Pokud je použitý tlak příliš vysoký, náklady na jeho výrobu přesahují cenu, kterou můžete získat za extra vyrobený amoniak.
katalyzátor,
Rovnováha úvahy,
katalyzátor nemá vliv na polohu rovnováhy. Přidání katalyzátoru nevytváří žádné větší procento amoniaku v rovnovážné směsi. Jeho jedinou funkcí je urychlit reakci.,
úvahy o rychlosti
při absenci katalyzátoru je reakce tak pomalá, že prakticky žádná reakce se nestane v žádném rozumném čase. Katalyzátor zajišťuje, že reakce je dostatečně rychlá, aby byla dynamická rovnováha nastavena ve velmi krátké době, kdy jsou plyny skutečně v reaktoru.
Oddělující amoniak
Když plyny opouštějí reaktor, jsou teplé a velmi vysoký tlak., Amoniak je snadno zkapalněn pod tlakem, pokud není příliš horký, a proto je teplota směsi dostatečně snížena, aby se amoniak obrátil na kapalinu. Dusík a vodík zůstávají jako plyny i při těchto vysokých tlacích a mohou být recyklovány.
Otázky otestovat své znalosti
Pokud je to první sada otázek jste udělal, prosím, přečtěte si úvodní stránku, než začnete. Budete muset použít tlačítko zpět v prohlížeči, abyste se sem vrátili.,
otázky týkající se procesu Haber
odpovědi
kam byste chtěli jít teď?
do rovnovážné nabídky . . .
do nabídky fyzikální chemie . . .
do hlavní nabídky . . .