Heterogenní Katalýzy
V heterogenní katalýzy katalyzátor je v jiné fázi z reaktantů. Alespoň jeden z reaktantů interaguje s pevným povrchem ve fyzickém procesu zvaném adsorpce takovým způsobem, že chemická vazba v reaktantu se stává slabou a pak se zlomí. Jedy jsou látky, které se nevratně vážou na katalyzátory, zabraňují adsorpci reaktantů a tím snižují nebo ničí účinnost katalyzátoru.,
příkladem heterogenní katalýzy je interakce plynného vodíku s povrchem kovu, jako je Ni, Pd nebo Pt. Jak je uvedeno v části (a) na Obrázku \(\PageIndex{2}\), vodík–vodíkové vazby a vytvářet individuální adsorbované atomy vodíku na povrchu kovu. Protože adsorbované atomy mohou pohybovat na povrchu, dva atomy vodíku může srazit a vytvořit molekulu vodíku, které pak mohou opustit povrch v opačném procesu, se nazývá desorpce. Adsorbované atomy H na kovovém povrchu jsou podstatně reaktivnější než molekula vodíku., Protože relativně silný H–H vazby (disociační energie = 432 kJ/mol) již byly rozbité, energetickou bariéru pro většinu reakcí H2 je podstatně nižší, na povrchu katalyzátoru.
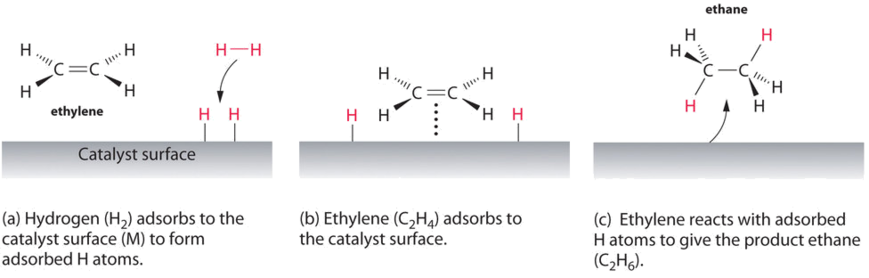
Obrázek \(\PageIndex{2}\) ukazuje proces zvaný hydrogenace, ve které atomy vodíku jsou přidány do dvojná vazba o to alken, jako je ethylen, aby produkt, který obsahuje C–C jednoduché vazby, v tomto případě ethanu., Hydrogenace se používá v potravinářském průmyslu převést rostlinných olejů, které se skládají z dlouhých řetězců alkenů, více komerčně cenné pevné deriváty, které obsahují alkylové řetězce. Hydrogenace některých dvojných vazeb v polynenasycených rostlinných olejích například produkuje margarín, produkt s bodem tání, strukturou a dalšími fyzikálními vlastnostmi podobnými vlastnostem másla.
několik důležitých příkladů průmyslových heterogenních katalytických reakcí je v tabulce \ (\PageIndex{1}\)., I když mechanismy těchto reakcí jsou podstatně složitější než jednoduché hydrogenační reakce popsané tady, všechny se týkají adsorpce reaktantů na pevný katalytického povrchu, chemické reakce v adsorbované druhy (někdy i přes řadu dílčích druhů), a konečně desorpce produktů z povrchu.