Un scurt rezumat al Procesul Haber
Procesul Haber combină azotul din aer cu hidrogenul derivate în principal din gaze naturale (metan) în amoniac. Reacția este reversibilă, iar producția de amoniac este exotermă.,
![]()
![]()
Un flux schema pentru Procesul Haber se pare ca acest lucru:
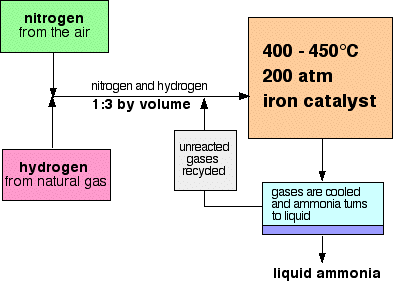
Unele note privind condițiile
catalizator
catalizatorului este de fapt puțin mai complicat decât pură de fier. Are hidroxid de potasiu adăugat la acesta ca promotor – o substanță care își mărește eficiența.presiunea variază de la o fabrică la alta, dar este întotdeauna ridicată. Nu poți merge departe greșit într-un examen citând 200 atmosfere.,la fiecare trecere a gazelor prin reactor, doar aproximativ 15% din azot și hidrogen se transformă în amoniac. (Această cifră variază, de asemenea, de la plantă la plantă.) Prin reciclarea continuă a azotului și hidrogenului nereacționat, conversia totală este de aproximativ 98%.
Explicarea condiții
proporțiile de azot și hidrogen,
amestec de azot și hidrogen intra în reactor este în raport de 1 volumul de azot la 3 volume de hidrogen.,legea lui Avogadro spune că volume egale de gaze la aceeași temperatură și presiune conțin un număr egal de molecule. Asta înseamnă că gazele intră în reactor în raportul dintre 1 moleculă de azot și 3 de hidrogen.
aceasta este proporția cerută de ecuație.
în unele reacții puteți alege să utilizați un exces de unul dintre reactanți. Ați face acest lucru dacă este deosebit de important să utilizați cât mai mult posibil celălalt reactant – dacă, de exemplu, a fost mult mai scump. Asta nu se aplică în acest caz.,
există întotdeauna o parte în jos pentru a folosi altceva decât proporțiile ecuației. Dacă aveți un exces de un reactant, vor exista molecule care trec prin reactor care nu pot reacționa, deoarece nu există nimic cu care să reacționeze. Acest lucru risipește spațiul reactorului – în special spațiul de pe suprafața catalizatorului.
temperatura
Echilibru considerații
Ai nevoie pentru a schimba poziția de echilibru, pe cât posibil, la dreapta, în scopul de a produce cantitatea maximă posibilă de amoniac în echilibru a amestecului.,reacția înainte (producția de amoniac) este exotermă.
![]()
![]()
Potrivit Le Chatelier e Principiu, acest lucru va fi favorizat daca scazi temperatura. Sistemul va răspunde prin mutarea poziției de echilibru pentru a contracara acest lucru-cu alte cuvinte, producând mai multă căldură.pentru a obține cât mai mult amoniac în amestecul de echilibru, aveți nevoie de o temperatură cât mai scăzută posibil. Cu toate acestea, 400 – 450°C nu este o temperatură scăzută!,cu cât temperatura pe care o utilizați este mai mică, cu atât reacția devine mai lentă. Un producător încearcă să producă cât mai mult amoniac pe zi. Nu are sens să încercați să obțineți un amestec de echilibru care conține o proporție foarte mare de amoniac dacă durează câțiva ani pentru ca reacția să ajungă la acel echilibru.aveți nevoie de gaze pentru a ajunge la echilibru într-un timp foarte scurt în care acestea vor fi în contact cu catalizatorul din reactor., 400 – 450°C este o temperatură de compromis care produce o proporție rezonabil de mare de amoniac în amestecul de echilibru (chiar dacă este doar 15%), dar într-un timp foarte scurt.
presiune
Echilibru considerații
![]()
![]()
Observați că există 4 molecule de pe partea stângă a ecuației, dar numai 2 pe dreapta.,conform principiului lui Le Chatelier, dacă măriți presiunea, sistemul va răspunde favorizând reacția care produce mai puține molecule. Asta va face ca presiunea să scadă din nou.pentru a obține cât mai mult amoniac în amestecul de echilibru, aveți nevoie de o presiune cât mai mare posibil. 200 atmosfere este o presiune ridicată, dar nu uimitor de mare.creșterea presiunii aduce moleculele mai aproape împreună., În acest caz special, va crește șansele lor de a lovi și de a se lipi de suprafața catalizatorului unde pot reacționa. Cu cât presiunea este mai mare, cu atât mai bine în ceea ce privește rata unei reacții de gaz.
considerații economice
presiunile foarte mari sunt foarte costisitoare pentru a produce pe două capete de acuzare.trebuie să construiți țevi extrem de puternice și vase de izolare pentru a rezista la presiunea foarte ridicată. Aceasta crește costurile de capital atunci când instalația este construită.presiunile ridicate costă foarte mult pentru a produce și menține., Asta înseamnă că costurile de funcționare ale fabricii dvs. sunt foarte mari.200 atmosfere este o presiune de compromis aleasă din motive economice. Dacă presiunea utilizată este prea mare, costul generării acesteia depășește prețul pe care îl puteți obține pentru amoniacul suplimentar produs.
catalizatorul
considerații de echilibru
catalizatorul nu are niciun efect asupra poziției echilibrului. Adăugarea unui catalizator nu produce nici un procent mai mare de amoniac în amestecul de echilibru. Singura sa funcție este de a accelera reacția.,în absența unui catalizator reacția este atât de lentă încât practic nu se întâmplă nicio reacție în orice moment sensibil. Catalizatorul asigură că reacția este suficient de rapidă pentru ca un echilibru dinamic să fie stabilit în timpul foarte scurt în care gazele sunt de fapt în reactor.
separarea amoniacului
când gazele părăsesc reactorul sunt fierbinți și la o presiune foarte mare., Amoniacul este ușor lichefiat sub presiune, atâta timp cât nu este prea fierbinte, astfel încât temperatura amestecului este redusă suficient pentru ca amoniacul să se transforme într-un lichid. Azotul și hidrogenul rămân ca gaze chiar și sub aceste presiuni ridicate și pot fi reciclate.
Întrebări pentru a testa înțelegerea dvs.
Dacă acesta este primul set de întrebări pe care le-am făcut, vă rugăm să citiți pagina introductivă înainte de a începe. Va trebui să utilizați butonul înapoi din browserul dvs. pentru a reveni aici după aceea.,
întrebări despre procesul Haber
răspunsuri
unde doriți să mergeți acum?
la meniul de echilibru . . .
la meniul de Chimie Fizică . . .
la meniul principal . . .