Atomi și Energie de Lumină
studiul atomilor și caracteristicile lor se suprapun mai multe differentsciences. Chimiștii, fizicienii și astronomii trebuie să înțeleagă scara microscopică la care funcționează o mare parte din Univers pentru a vedea „imaginea de ansamblu”.,
în Interiorul Atomului
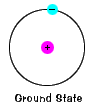 |
starea De bază a unui electron, nivelul de energie itnormally ocupă, este statul cel mai mic de energie pentru că electron. |
| Există, de asemenea, un maxim de energie pe care fiecare electron poateau și să fie în continuare parte din atom. Dincolo de această energie, electronis nu mai este legat de nucleul atomului și este considerat tobe ionizat., | 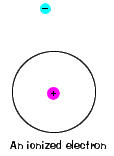 |
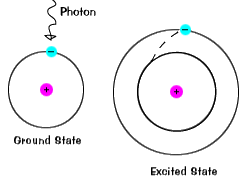 |
atunci Când un electron ocupa temporar o stare de energie mai mare decât itsground de stat, este într-o stare excitată.Un electron poate deveni excitat dacă este dat un plus de energie, cum ar fi dacă itabsorbs un foton, sau pachete de lumina, sau se ciocnește cu un atom din apropiere sau de particule. |
Energia Luminii
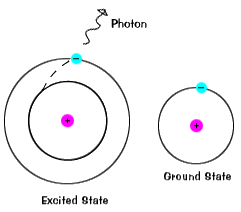 |
Electronii nu sta în stări excitate pentru foarte mult timp – au soonreturn la sol lor membre, emite un foton cu sameenergy ca unul care a fost absorbit., |
Identificarea diferitelor Tipuri de Atomi
Tranziții între diferitele orbitali sunt unice pentru fiecare element pentru theenergy niveluri sunt unic determinate de protoni și neutroni în thenucleus. Știm că diferite elemente au un număr diferit deprotoni și neutroni în nucleele lor. Când electronii unui anumit atom se întorc la orbitele inferioare din stările excitate, fotonii pe care îi emit au energii caracteristice acestui tip de atom., Acest lucru oferă fiecareelement o amprentă unică, făcând posibilă identificarea elementelorprezent într-un recipient de gaz sau chiar o stea.putem folosi instrumente precum tabelul periodic al elementelor pentru a ne da seama exactcâți protoni, și astfel electroni, are un atom. În primul rând, știm că pentru ca un atom să aibă o sarcină neutră, trebuie să aibă același număr deprotoni și electroni. Dacă un atom pierde sau câștigă electroni, devineionizat sau încărcat. Tabelul periodic ne va da numărul atomic deun element. Numărul atomic ne spune câți protoni un atomare., De exemplu, hidrogenul are un număr atomic de unul – ceea ce înseamnă că areUn proton și, prin urmare, un electron – și de fapt nu are neutroni.
Pentru Student
Bazează pe descrierea anterioară a atomului, trage amodel atomului de hidrogen. Modelul” standard ” al unui atom este cunoscutca model Bohr.
diferite forme ale aceluiași element chimic care diferă numai prin numărulde neutroni din nucleul lor se numesc izotopi. Majoritatea elementelor aumai mult decât un izotop natural., Au fost mai mulți izotopiproduse în reactoare nucleare și laboratoare științifice. Izotopii de obicei nu sunt foarte stabili, și au tendința de a suferi dezintegrare radioactivă până când se formează ceva mai stabil. Este posibil să fiți familiarizați cu elementuluranium-are mai mulți izotopi instabili, U-235 fiind unul dintre cei mai cunoscuți. 235 înseamnă că această formă de uraniu are neutroni 235și protoni combinați. Dacă am căuta numărul atomic al uraniului și am afla că de la 235, am putea calcula numărul de neutroni pe care îl are izotopul.,iată un alt exemplu-carbonul apare de obicei sub formă de C-12 (carbon-12), adică 6 protoni și 6 neutroni, deși un izotop este C-13, cu 6protoni și 7 neutroni.
pentru Student
folosiți tabelul periodic și numele elementelor de mai jos pentru a afla câți protoni, neutroni și electroni au.Desenați un model al unui atom cu următorul element: siliciu-28,magneziu-24, sulf-32, oxigen-16 și heliu-4.,
Pentru Student
Folosind text, definiți următorii termeni: nivelul de energie, de absorbție, emisie, entuziasmat de stat, de stat la sol, ionizare,atom, element, masă atomică, număr atomic, izotop.
O Notă Opțională pe Mecanica Cuantică Natura Atomilorîn Timp ce Bohr a atomului descris mai sus este un frumos mod de a învăța despre structura atomilor, nu este modul cel mai precis tomodel ei.,deși fiecare orbital are o energie precisă, electronul este acum imaginat ca fiind împrăștiat într-un”nor de electroni” care înconjoară nucleul. Aceasta este comun pentru a vorbi de medie distanta de la thecloud ca raza electronului pe orbită.Deci, amintiți-vă doar, vom păstra cuvintele „orbită” și „orbital”, deși noi acum le folosesc pentru a descrie nu un tv cu planul orbitei, dar aregion în cazul în care un electron are o probabilitate de a fi. electronii sunt ținuți aproapenucleus prin atracția electrică dintre nucleu și electroni.,Păstrate acolo în același mod în care cele nouă planete stau lângă Soare în loc de a călători în galaxie. Spre deosebire de sistemul solar, unde toate orbitele planetelorsunt pe același plan, orbitele electronilor sunt mai tridimensionale. Fiecarenivelul energetic pe un atom are o formă diferită. Există ecuații matematice care vă vor spune probabilitatea localizării electronului în acea orbită.să luăm în considerareatomul de hidrogen, pe care l-am desenat deja un model Bohr.,
textul și imaginile din această secțiune au fost adaptate din pagina lui Dave Slaven pe Atom (vezi referințele de mai jos). |

