Nucleofil Înlocuirea grupării Hidroxil
comportamentul chimic al halogenuri de alchil poate fi folosit ca o referință în descoperirea analog de substituție și de eliminare reacții de alcooli. Diferența principală, desigur, este o schimbare a anionului care pleacă de la halogen la hidroxid. Deoarece oxigenul este puțin mai electronegativ decât clorul (3.5 vs.2.8 pe scara Pauling), legătura C-O este de așteptat să fie mai polară decât o legătură C-Cl., În plus, o măsură independentă de electrofile caracteristicile de atomi de carbon din RMN deplasările chimice (ambele 13C și alfa, protoni) indică faptul că oxigenul și clorul substituenți exercita o similare electron-retragerea de influență atunci când legați la atomi de carbon hibridizați sp3. În ciuda acestor dovezi promițătoare de fond, alcoolii nu suferă aceleași reacții SN2 observate frecvent cu halogenuri de alchil. De exemplu, reacția rapidă SN2 a 1-brombutanului cu cianură de sodiu, prezentată mai jos, nu are o paralelă atunci când 1-butanolul este tratat cu cianură de sodiu., De fapt, alcoolul etilic este adesea folosit ca solvent pentru reacțiile de substituție cu halogenură de alchil, cum ar fi acesta.
CH3CH2CH2CH2–Br + Na(+) NC(–)  CH3CH2CH2CH2–NC + Na(+) Br(–)
CH3CH2CH2CH2–NC + Na(+) Br(–)
CH3CH2CH2CH2–OH + Na(+) NC(–)  Nici o Reacție
Nici o Reacție
factorul cheie aici este stabilitatea lăsând anioni (bromură vs hidroxid)., HBr este un acid mult mai puternic decât apa (cu mai mult de 18 ordine de mărime), iar această diferență se reflectă în reacțiile care generează bazele conjugate respective. Baza mai slabă, bromura, este mai stabilă, iar eliberarea sa într-o reacție de substituție sau eliminare este mult mai favorabilă decât cea a ionului de hidroxid, o bază mai puternică și mai puțin stabilă.
un pas clar spre îmbunătățirea reactivității alcoolilor în reacțiile SN2 ar fi modificarea grupului funcțional –OH într-un mod care să-i îmbunătățească stabilitatea ca anion care pleacă., O astfel de modificare este de a efectua reacția de substituție într –un acid puternic, transformând –OH în-OH2(+). Deoarece ionul hidroniu (H3O (+)) este un acid mult mai puternic decât apa, baza sa conjugată (H2O) este o grupă mai bună decât ionul de hidroxid. Singura problemă cu această strategie este că mulți nucleofili, inclusiv cianura, sunt dezactivați prin protonare în acizi puternici, eliminând efectiv co-reactantul nucleofil necesar pentru substituție., Acizii puternici HCl, HBr și HI nu sunt supuși acestei dificultăți, deoarece bazele lor conjugate sunt nucleofile bune și sunt baze chiar mai slabe decât alcoolii. Următoarele ecuații ilustrează unele reacții de substituție ale alcoolilor care pot fi afectați de acești acizi. Ca și în cazul halogenurilor alchilice, substituția nucleofilă a alcoolilor 1º are loc printr-un mecanism SN2, în timp ce alcoolii 3º reacționează printr-un mecanism SN1. Reacțiile alcoolilor 2º pot apărea prin ambele mecanisme și produc adesea unele produse rearanjate., Numerele din paranteze de lângă formulele de acid mineral reprezintă procentul în greutate al unei soluții apoase concentrate, forma în care acești acizi sunt utilizați în mod normal.
deși aceste reacții sunt uneori denumite” catalizate de acid”, acest lucru nu este strict corect. În transformarea generală, un acid HX puternic este transformat în apă, un acid foarte slab, astfel încât este necesară cel puțin o cantitate stoechiometrică de HX pentru o conversie completă a alcoolului în halogenură de alchil., Necesitatea utilizării unor cantități echivalente de acizi foarte puternici în această reacție limitează utilitatea sa la alcooli simpli de tipul prezentat mai sus. Alcoolii cu grupuri sensibile la acid nu tolerează, desigur, un astfel de tratament. Cu toate acestea, ideea modificării grupului funcțional-OH pentru a-și îmbunătăți stabilitatea ca anion care pleacă poate fi urmărită în alte direcții. Următoarea diagramă prezintă unele modificări care s-au dovedit eficiente. În fiecare caz, gruparea hidroxil este transformată într-un ester al unui acid puternic. Primele două exemple arată esterii sulfonați descriși mai devreme., Al treilea și al patrulea exemplu arată formarea unui ester fosfit (X reprezintă restul de brom sau substituenți suplimentari de alcool) și, respectiv, un ester clorosulfit. Toate aceste grupuri care părăsesc (albastru colorat) au acizi conjugați care sunt mult mai puternici decât apa (cu 13 până la 16 puteri de zece); astfel, anionul care pleacă este în mod corespunzător mai stabil decât ionul de hidroxid. Compușii mesilat și tosilat sunt deosebit de utili deoarece pot fi utilizați în reacțiile de substituție cu o mare varietate de nucleofili., Intermediarii produși în reacțiile alcoolilor cu tribromură de fosfor și clorură de tionil (ultimele două exemple) sunt rareori izolați, iar aceste reacții continuă să producă produse de bromură de alchil și clorură.
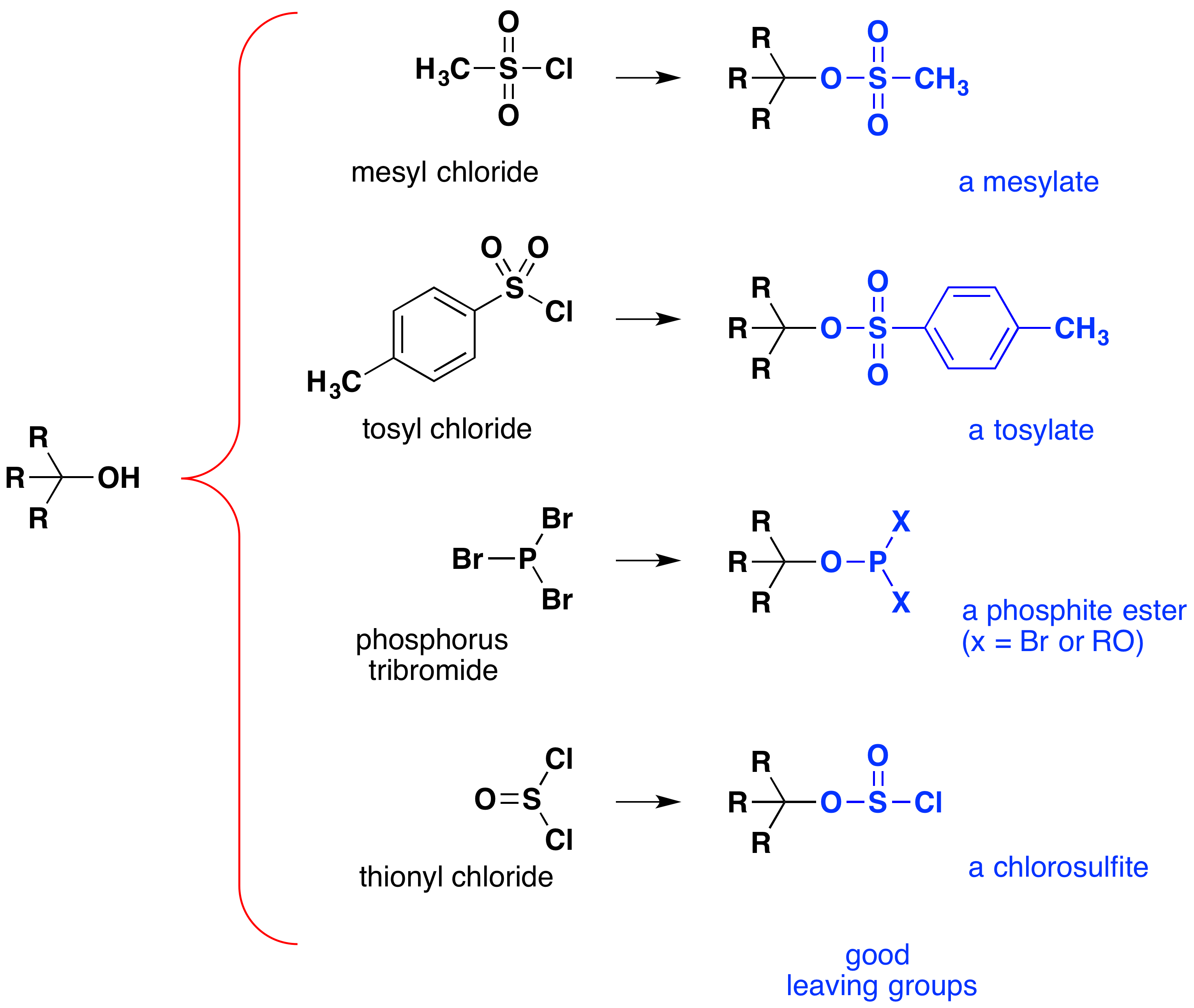
importanța sulfonat ester intermediari în general nucleofil reacții de substituție de alcooli poate fi ilustrată prin următoarea conversie de 1-butanol să pentanenitrile (butil cianură), o reacție care nu se produce cu alcool singur., Halogenurile de fosfor și tionil, pe de altă parte, acționează numai pentru a converti alcoolii în halogenurile alchil corespunzătoare.,
| CH3CH2CH2CH2–OH + CH3SO2Cl | pyridine
|
CH3CH2CH2CH2–OSO2CH3 | Na(+) CN(–)
|
CH3CH2CH2CH2–CN + CH3SO2O(–) Na(+) |
Some examples of alcohol substitution reactions using this approach to activating the hydroxyl group are shown in the following diagram., Primele două cazuri servesc la întărirea faptului că derivații esteri sulfonați ai alcoolilor pot înlocui halogenurile alchil într-o varietate de reacții SN2. Următoarele două cazuri demonstrează utilizarea tribromurii de fosfor în transformarea alcoolilor în bromuri. Acest reactiv poate fi utilizat fără adaos de bază (de exemplu, piridină), deoarece produsul acid fosforic este un acid mai slab decât HBr. Tribromura de fosfor este cel mai bine utilizată cu alcooli 1º, deoarece alcoolii 2º produc adesea produse secundare de rearanjare rezultate din reacțiile SN1 concurente., Rețineți că oxigenul eteric din reacția 4 nu este afectat de acest reactiv, în timp ce sinteza alternativă care utilizează HBR concentrat scindează eterii. Triclorură de fosfor (PCl3) convertește alcooli să cloruri de alchil într-o manieră similară, dar thionyl chloride este de obicei preferat pentru această transformare, deoarece produsele anorganice sunt gaze (SO2 & HCl). Triiodura de fosfor nu este stabilă, dar poate fi generată in situ dintr-un amestec de fosfor roșu și iod și acționează pentru a converti alcoolii în ioduri de alchil., Ultimul exemplu arată reacția clorurii de tionil cu un alcool chiral de 2º. Prezența unei baze organice, cum ar fi piridina, este importantă deoarece asigură o concentrație substanțială de Ion de clorură necesară pentru reacția finală SN2 a intermediarului clorosufit., În absența unei baze, chlorosufites se descompun la încălzire cu randament așteptat de clorură de alchil cu retenție de configurare
alcooli Terțiari nu sunt frecvent utilizate pentru reacții de substituție de tipul celor discutate aici, pentru că SN1 și E1 reacție căi sunt dominante și sunt dificil de controlat.

importanța sulfonat esteri ca intermediari în multe reacții de substituție nu poate fi supraevaluat., O dovadă riguroasă a inversiunii configuraționale care apare la locul de substituție în reacțiile SN2 face uz de astfel de reacții. Un exemplu de astfel de dovadă este afișat mai jos. Abrevierile pentru derivații de sulfonil mai frecvent utilizați sunt prezentate în tabelul următor.
| Sulfonil Grup | CH3SO2– | CH3C6H4SO2– | BrC6H4SO2– | CF3SO2– |
|---|---|---|---|---|
| Nume & Abbrev., | Mesyl sau Ms | Tosyl sau Ts | Brosyl sau Bs | Trifyl sau Tf |
Inversiune Dovada

Pentru o discuție mai completă a hidroxil reacții de substituție și o descriere a altor metode neselective pentru această transformare, Click Aici.
contribuitori
- William Reusch, Profesor Emerit (Michigan State U.,), Virtual Textbook of Organic Chemistry