Introducere
în Timpul iernii, uneori dermatologi primi pacienți asimptomatici, fără leziuni specifice, altele decât, poate, unele post-inflamatorii, modificări de culoare, dar cu o nevoie disperată de ajutor. Ei încep să spună povestea unui număr de papule sau vezicule care apar pe pielea lor după prima expunere intensă la soare a anului., Împreună cu leziunile, o mâncărime teribilă începe și crește odată cu răspândirea bolii, urmând următoarea expunere la soare, uneori agravată de un fel de senzație de arsură. Cu toate acestea, acești oameni sunt căutători de soare model și continuă să se bucure de soare pe tot parcursul verii, așteptând ca papulele să se estompeze treptat și să dispară. Principalele întrebări sunt: Cum pot preveni acest lucru? De ce primesc această problemă de la ” 5 ” ani acum, dar nu am avut-o niciodată înainte?,cel mai probabil avem de-a face cu erupția polimorfă a luminii (PLE) și, în urma solicitărilor pacienților noștri, cercetarea medicală s-a concentrat în principal pe strategiile de prevenire, devenind astăzi destul de satisfăcătoare. Pe de altă parte, a doua întrebare și cu siguranță mai puțin explorată rămâne neclară, cu excepția cazului în care au fost adăugate mai multe piese la acest puzzle destul de complicat. Scopul acestei scurte revizuiri este de a relua cele mai recente progrese în mecanismele posibile PLE și protocoalele cele mai utilizate pentru prevenire sau tratament.
patofiziologia erupției luminoase polimorfe: ce este nou?,PLE este cea mai frecventă tulburare fotosensibilă, caracterizată printr-o erupție intermitentă a papulelor, veziculelor sau plăcilor eritematoase pruriginoase care nu se cicatrizează (Figura 1) care se dezvoltă în câteva ore de la expunerea la radiații ultraviolete (UVR) a pielii pacientului. Boala este dependentă de susceptibilitatea genetică, precum și componenta de mediu, cum ar fi tipul de expunere. PLE pare să se grupeze în familii: s-a estimat că prevalența PLE a fost de 21 și 18% la gemenii monozigoți, respectiv dizigoți (1)., Mai mult decât atât, un istoric familial pozitiv de PLE la rudele de gradul întâi a fost prezent la 12% dintre afectate twin perechi privire la 4% din neafectat twin perechi (p < 0.0001). Concordanța probandwise la monozigoți a fost superioară perechilor gemene dizigotice (0,72 vs. 0,30, respectiv), demonstrând un efect genetic puternic (1). Multe gene de interes potențial în patogeneza PLE au fost investigate cu rezultate, în general, nerevendatoare., Folosind analiza segregării, s-a estimat că 72% din populația din Marea Britanie poartă o alelă de susceptibilitate PLE cu penetranță scăzută (2).
figura 1
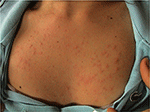
Figura 1. Imaginea clinică a erupției luminoase polimorfe la o femeie tânără.
Eșecul de Apoptoză: Posibile Foto-Induse Neo Antigene

Figura 1. Imaginea clinică a erupției luminoase polimorfe la o femeie tânără.
Într-un recent genome-wide analiza expresiei, doar 16 gene au fost diferit exprimate între PLE și sănătoși după iradiere UV privire la control (3)., Dintre aceste gene, 14 au prezentat o expresie mai scăzută la pacienții cu PLE, în timp ce două au rezultat supra-exprimate. Printre cele 14 gene cu mici exprimare în PLE sunt: complement 1s subunitate (C1s), scavenger receptor B1 (SCARB1) fibronectinei (FN1), superfamiliei imunoglobulinelor membru 3 (IGSF3), caspazei-1 (CASP1) și paraoxonazice 2 (PON2), toate genele asociate cu celule apoptotice clearance-ul. S-a presupus că modificarea proteinei în timpul clearance-ului celular apoptotic ar putea duce la formarea potențială a antigenului auto (4)., Apoi, expresia redusă la pacienții cu PLE a genelor legate de acest proces ar putea reprezenta o posibilă sursă de auto-antigen, precum și o fază crucială în inițierea procesului autoimun care favorizează boala (3). În conformitate cu aceste constatări, Kuhn și colab. a arătat acumularea de celule apoptotice în PLE pacienților iradiați fie cu 1,5 Minimă Doza Eritem (MED) din UVB, sau 60-100 J/cm2 de UVA1, comparativ cu lotul de control (5).,
imunitate: eșecul toleranței
auto-antigenele derivate din clearance-ul ineficient al celulelor apoptotice sunt probabil preluate de celulele dendritice (DCs) și prezentate celulelor T naive (citotoxice și helper) transformate ulterior în celule T auto-reactive (6, 7). Acest eșec parțial al apoptozei contribuie, împreună cu imunosupresia inadecvată după expunerea la UV, la recunoașterea și prezentarea antigenului, conducând la manifestarea clinică tipică pacienților cu PLE (8)., Într-adevăr, eșecul imunosupresiei normale induse de UVR a fost dovedit ca principala anomalie imunologică în PLE, explicată inițial prin permanența celulelor Langerhans (LCs) în epidermă. Această supra-activare a sistemului imunitar, care scapă de toleranța funcțională indusă de UV, este probabil responsabilă de prevalența redusă a cancerului de piele la pacienții cu PLE (9). Pe de altă parte, același mecanism este vinovat pentru eșecul supresiei dermatitei alergice de contact (ACD), după expunerea la UVR (10).,
Inflamatorii Cale: Hipersensibilitate de Tip Întârziat Reacția
mecanisme imunologice implicate în PLE, cu mediatorii din înnăscute și adaptative, sunt foarte similare, fie din histologic sau punct de vedere biochimic, la ACD altele. De fapt, la începutul anilor șaptezeci, Epstein a indicat mai întâi PLE ca reacție de hipersensibilitate de tip întârziat (DTHR) la antigenul cutanat indus de UVR nedefinit (11). Recent, pentru a consolida acest concept, unii dintre mediatorii inflamatori implicați în ACD au fost demonstrați și în PLE., De exemplu, familia IL-1 (12, 13), un grup în creștere de citokine care joacă mai multe roluri în reglarea imună și inflamație (14), implicată și în patogeneza ACD (12, 15), a fost explorată și în PLE (16). IL-36α și IL-36γ, pro-inflamatorii membrii de IL-1 de familie au crescut în PLE privire la controale, ca pentru ACD probe, dar IL-36γ a fost mult îmbunătățită în PLE decât în ACD (16). Acționează prin comune receptorilor compus din IL-36R și IL-1R/AcP (IL-1RL2), IL-36α, IL-36β, și IL-36γ activarea NF-kB și MAPKs, promovarea reacții inflamatorii., Creșterea IL-36S în piele și sângele periferic al pacienților cu PLE indică activarea răspunsului imun local și sistemic, așa cum se constată în multiple afecțiuni cutanate inflamatorii (15, 17, 18). Probabil, legătura dintre expunerea IL-36S și UVR este reprezentată de semnalul proinflamator paracrin al activării receptorului toll like (TLR)-3, datorită eliberării ARN de către keratinocitele necrotice (19). Într-adevăr, eșecul clearance-ului apoptotic în PLE, cu abundență de resturi celulare, ar putea fi responsabil pentru o amplificare a acestui „semnal de alertă.,mai mult, IL-36S ar putea contribui la amplificarea semnalului imun înnăscut și a cascadei inflamatorii în consecință, promovând peptidele antimicrobiene (AMPs) (20).
Inflamatorii Cale: Amplificatoare și Microbiome
în mare măsură examinată în mai multe pielea procese inflamatorii, aceste mediatori, numit defensins (α și β), cathelicidin (LL37), ribonuclează 7 (RNase7) și psoriasin (S100A7), în lumina dezechilibru indus de UVR pe keratinocite și pielea microbiome, de asemenea, au fost investigate în PLE (21, 22). Patra și colab., au descoperit ca expresie a psoriasin, RNase7, HBD-2, și LL-37 a fost crescut într-PLE piele lezional, întrucât HBD-3 a fost scăzut. Considerând suprafața pielii ca o „lume multietnică”, fără a uita rolul crucial al keratinocitelor, nu putem exclude că eliberarea amperilor ar putea fi determinată prin modificarea componentelor microbiomului după interacțiunea UV (23). Într-adevăr, microbiomul ar putea reprezenta sursa, directă sau indirectă, a antigenelor induse de UVR încă nedetectate formate la pacienții cu PLE, ceea ce duce la afectarea keratinocitelor., În consecință, LL-37, indus și de UVB, IFNy, TNF-α, IL-6, ar putea reprezenta un potențial factor indirect al PLE (23). Poate forma agregate cu acizi auto-nucleici capabili să activeze pDCs: în psoriazis a fost recunoscut ca principal autoantigen (24). Chiar dacă la pacienții cu PLE a fost raportată o absență completă a PDC (25), există un mediu autoimun, iar LL-37 ar putea juca un rol esențial, inducând alte căi inflamatorii. În figura S1 (material suplimentar), conceptele exprimate mai sus sunt vizualizate într-un desen animat.
terapia erupției luminoase polimorfe: ce este nou?,
prima linie de tratament pentru PLE include evitarea soarelui, protecția solară și corticosteroizii topici (26). Pentru toți pacienții, managementul preventiv este fundamental pe vreme însorită, prin evitarea expunerii intense la UVR și utilizarea îmbrăcămintei de protecție, precum și aplicarea de protecție solară, în special în timpul primei expuneri a anului. S-a raportat că noua generație de protecție solară cu spectru larg, cu factor ridicat de protecție solară pentru UVB (SPF), împreună cu protecție UVA cu lungime de undă mai mare, conferă protecție totală sau parțială la până la 90% dintre pacienții cu PLE (27, 28)., Utilizarea antioxidanților orali și a nicotinamidei ar putea reprezenta o măsură preventivă suplimentară valabilă pentru acești pacienți. Efectele benefice ale nicotinamidei au fost investigate într-un studiu necontrolat la 42 de pacienți, unde 60% dintre aceștia au raportat abolirea completă a simptomelor atunci când au luat 2-3 g de nicotinamidă zilnic, înainte de expunerea la soare (29). Mai mult, sa demonstrat că un extract de Polypodiumleucotomos de ferigă tropicală [PL) exercită atât efecte antioxidante puternice, cât și imunomodulatoare., Când a fost administrat la 480 mg / zi înainte de expunerea la soare, a redus semnificativ reacțiile cutanate și simptomele subiective (30, 31). În ceea ce privește corticosteroizii topici, chiar dacă nu au fost efectuate studii pentru a determina eficacitatea lor în PLE, acestea sunt utilizate pe scară largă pentru a reduce mâncărimea (26). A doua linie de tratamente pentru PLE include corticosteroizi sistemici și terapie foto(chemo) (26). Într-un studiu randomizat, dublu-orb, controlat cu placebo (32), autorii au sugerat utilizarea a 25 mg prednisolon zilnic timp de 4-5 zile la debutul erupției., Deși trebuie luate în considerare potențialele efecte secundare pe termen lung ale curelor repetate de prednisolon, aceasta ar putea fi recomandată pacienților care suferă de atacuri ocazionale de PLE, în absența oricăror contraindicații. În cazurile mai blânde de PLE, un program de auto-condiționare prin expunerea absolventă la lumina soarelui în primăvară poate fi suficient (33). Întrucât, în cazuri mai severe, tratamentul de condiționare/desensibilizare supravegheat medical poate fi mai adecvat., Un curs de terapie psoralen și UVA (PUVA), bandă îngustă (NB)-UVB sau fototerapie în bandă largă (BB)-UVB, administrat de obicei la începutul primăverii, poate fi eficient, precum și tratament profilactic (26). Protocolul de tratament constă, în general, dintr-un curs de fototerapie/fotochimoterapie pe parcursul a 5-6 săptămâni. Dozele inițiale depind de doza minimă eritemală (MED) sau de doza minimă fototoxică (MPD) și reprezintă frecvent 50-70% din aceste praguri măsurate, cu creșteri incrementale., Pentru a menține beneficiul obținut cu terapia de desensibilizare, se recomandă o expunere regulată la soare pe parcursul verii, altfel întărirea ar putea fi pierdută în 4-6 săptămâni. În tratamentul PLE, NB-UVB ar trebui să fie preferat PUVA (puterea recomandării D; nivelul dovezilor 4), din cauza riscului mai mic de fotocarcinogeneză, a riscului de greață sau a altor efecte secundare asociate cu ingestia de MOP și a necesității de a utiliza protecția ochilor post-tratament. Cu toate acestea, PUVA trebuie luată în considerare, înainte de alte tratamente sistemice, dacă NB-UVB a eșuat sau a declanșat anterior erupția., De fapt, așa cum este descris mai jos, eficacitatea a fost dovedită pentru regimurile multiple de fototerapie (BB-UVB, NB-UVB și PUVA), iar efectele secundare, în ceea ce privește provocarea erupțiilor cutanate, eritemul și mâncărimea s-au dovedit a fi mai frecvente la UVB decât la PUVA (34). După cum se rezumă, în literatura de specialitate, eficacitatea PUVA are ca rezultat o rată de fotoprotecție de 65-100% (34)., Au fost efectuate mai multe studii comparative, dar din singurul studiu randomizat controlat între PUVA și NB-UVB plus comprimate placebo, de trei ori pe săptămână, timp de 5 săptămâni, nu a apărut nicio diferență semnificativă în eficacitate, având în vedere apariția PLE sau restricționarea activității în aer liber (35). În revizuirea retrospectivă de 10 ani, raportată de Man et al. (36), 170 de pacienți cu PLE moderată până la severă au primit fototerapie PUVA și/sau UVB. În detaliu, 8 pacienți au primit PUVA, 128 NB-UVB, 5 BB-UVB și 29 de pacienți, care nu au răspuns satisfăcător la NB-UVB, au primit PUVA în anul următor., S-au făcut autoevaluări ale gravității, iar frecvența episoadelor de PLE a fost raportată la vizitele de urmărire din toamnă sau din primăvara următoare. Îmbunătățirea bună sau moderată a fost raportată la 88% dintre pacienții tratați cu PUVA și la 89% care au primit UVB. Dintre pacienții tratați atât cu PUVA, cât și cu NB-UVB, majoritatea au preferat PUVA. Într-un alt studiu retrospectiv de 14 ani pe 79 de pacienți tratați cu fototerapie (37), eficacitatea, măsurată în vara următoare în termeni de fotoprotecție cu remisiune completă/parțială, a fost de 65% pentru PUVA, 82% pentru BB-UVB și 83% pentru UVA în monoterapie., În acest caz, tratamentul cu PUVA a fost rezervat formelor mai severe de PLE.mecanismele prin care fototerapia induce fotoprotecția nu sunt pe deplin înțelese.cu toate acestea, în ultimii ani au fost efectuate multe progrese. În plus față de efectele bine cunoscute asupra melaninizării și îngroșării epidermice a fototerapiei, sunt raportate o gamă largă de proprietăți imunomodulatoare și antiinflamatorii induse de UV (38)., UVB și UVA modula aderență molecula de exprimare și induce mediatori solubili, cum ar fi hormonul de stimulare de melanocite, IL-10 (care suprima productia de interferon γ) și a prostaglandinei E2, care explica acțiuni anti-inflamatorii, prevenind activarea celulelor T și promovarea apoptozei de piele infiltrarea celulelor T (34). Mai mult, s-a demonstrat că întărirea profilactică a razelor UV la pacienții cu PLE restabilește migrarea LC indusă de UV de la epidermă la ganglionii limfatici care drenează pielea: unul dintre evenimentele celulare cheie în imunosupresia UV (39)., Toleranța indusă de LC este mediată de eliberarea de citokine imunosupresoare, cum ar fi IL-10, și de interferența cu maturarea și inducerea celulelor T reglatoare (Tregs) (40). Mai mult, recent, a fost raportată o legătură interesantă între LC, Tregs și vitamina D3. Într-adevăr, s-a demonstrat că un pre-tratament topic pe termen scurt de 1 săptămână cu analogul de 1,25-dihidroxivitamină D, calcipotriol, a diminuat simptomele PLE după fotoprovocația experimentală ulterioară (41)., În plus, într-un studiu murin, 1,25-dihidroxivitamina D a prezentat efecte imunosupresoare comparabile cu UV (42). Un alt crosstalk interesant a fost evidențiat între LCs și celulele mastocite. În plus față de rolul lor recunoscut în atopie, celulele mastocite dermice sunt, de asemenea, responsabile pentru protejarea pielii de inflamația indusă de UVB, promovând imunosupresia UV (40). Studiile la om au demonstrat că, după expunerea acută și cronică la UVR, numărul mastocitelor dermice crește, împreună cu eliberarea IL-10., În general, aceste date sugerează un rol potențial pentru celulele mastocite în PLE și în mecanismul de întărire a fotografiei. În conformitate cu aceasta, Wolf și colab. au raportat, pentru prima dată, că fotohardeningul crește semnificativ densitatea celulelor mastocite în dermul papilar al pacienților cu PLE (40). Rezumând, fotohardeningul funcționează în PLE prin restabilirea căii normale de supresie imună UV, implicând mai multe tipuri de celule. Tratamentul de a treia linie pentru PLE include utilizarea de medicamente imunosupresoare sistemice, cum ar fi azatioprina și ciclosporina., Cu toate acestea, în literatura de specialitate sunt raportate doar cazuri sporadice de pacienți tratați cu succes (43, 44). Mai mult decât atât, hidroxiclorochina, acizii grași omega-3 și beta-carotenul au fost propuse ca tratamente, dar sunt necesare studii controlate dublu-orb, randomizate, pentru a evalua cu adevărat eficacitatea lor clinică.deoarece prevalența ridicată și incidența crescândă a PLE, asociate disconfortului și restricțiilor stilului de viață, sunt necesare studii viitoare pentru a găsi noi strategii terapeutice și/sau preventive., Alegerea tratamentului adecvat PLE necesită o bună cunoaștere a cursului clinic individual al bolii, împreună cu posibilitatea efectuării fototestului. Au fost evidențiate unele aspecte noi în posibila activare și promovare a procesului inflamator.,la stadiul actual al cunoașterii, în ciuda identificării unor reglementări celulare cruciale implicate în restabilirea toleranței imune, este dificil să se tragă concluzii clare cu privire la eficacitatea diferitelor tratamente potențiale în PLE, din cauza lipsei studiilor adecvate și a dificultății în evaluarea măsurilor de rezultat. Scorul clinic pentru evaluarea severității PLE (PLESI) (45) rămâne un instrument utilizat cu greu și limitat în principal la scopuri de cercetare., Studiul mai profund al mecanismelor patogenetice care stau la baza tulburării va permite o abordare mai direcționată a tratamentului.SL a proiectat manuscrisul, a selectat materialul pentru lucrare, a scris proiectul inițial și a corectat următoarele proiecte ale manuscrisului. AR a fost implicat în scrierea manuscrisului, susținând noi idei de conținut și stil.,
Declarație privind conflictul de interese
autorii declară că cercetarea a fost efectuată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
material suplimentar
figura S1. Interacțiunea dintre sistemul imunitar înnăscut și adaptiv într-un context de eșec apoptoză în epidermă. (Simbol verde) Psoriazin: Expresie abundentă în straturile spinoase și granulare ale pielii PLE. (Simbol albastru) RNase7: exprimat în principal în keratinocite ale stratului granulosum și ale stratului cornos al leziunilor PLE., (Simbol galben) LL-37 a fost profund exprimat în și în jurul vaselor de sânge și glande în PLE. (Simbolul celulei violete) keratinocite apoptotice cu clearance ineficient.,hic light eruption; ACD, Allergic contact dermatitis; DTHR, Delayed type hypersensitivity reaction; UVR, Ultraviolet radiation; C1s, Complement 1s subunit; SCARB1, Scavenger receptor B1; FN1, Fibronectin; IGSF3, Immunoglobulin superfamily member 3; CASP1, Caspase-1; PON2, Paraoxonase 2; MED, Minimal Erythema Dose; DCs, Dendritic cells; LCs, Langerhans cells; TLR, Toll like receptor; AMPs, Antimicrobial peptides; SPF, Sun protection factor; PUVA, Psoralen and UVA therapy; NB-UVB, Narrowband; BB-UVB, Broadband UVB; MPD, Minimum phototoxic dose; Tregs, Regulatory T cells; PL, Polypodiumleucotomos.,
2. McGregor JM, Grabczynska S, Vaughan R, Hawk JL, Lewis CM. Genetic modelling of abnormal photosensitivity in families with polymorphic light eruption and actinic prurigo. J Invest Dermatol. (2000) 115:471–6. doi: 10.1046/j.1523-1747.2000.00080.x
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Lembo S, Hawk JLM, Murphy GM, Kaneko K, Young AR, McGregor JM, et al., Aberrant gene expression with deficient apoptotic keratinocyte clearance may predispose to polymorphic light eruption. Br J Dermatol. (2017) 177:1450–3. doi: 10.1111/bjd.15200
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Savill J, Fadok V. Corpse clearance defines the meaning of cell death. Nature (2000) 407:784–8. doi: 10.,1038/35037722
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Kuhn A, Herrmann M, Kleber S, Beckmann-Welle M, Fehsel K, Martin-Villalba A, et al. Accumulation of apoptotic cells in the epidermis of patients with cutaneous lupus erythematosus after ultraviolet irradiation. Arthritis Rheum. (2006) 54:939–50. doi: 10.1002/art.21658
PubMed Abstract | CrossRef Full Text | Google Scholar
6., Savill J, Dransfield I, Gregory C, Haslett C. A blast from the past: clearance of apoptotic cells regulates immune responses. Nat RevImmunol. (2002) 2:965–75. doi: 10.1038/nri957
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Albert ML, Sauter B, Bhardwaj N. Dendritic cells acquire antigen from apoptotic cells and induce class I-restricted CTLs. Nature (1998) 392:86–9. doi: 10.,1038/32183
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Koulu LM, Laihia JK, Peltoniemi HH, Jansén CT. UV-induced tolerance to a contact allergen is impaired in polymorphic light eruption. J Invest Dermatol. (2010) 130:2578–82. doi: 10.1038/jid.2010.181
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Epstein JH. Polymorphous light eruption. J Am Acad Dermatol. (1980) 3:329–43.,
PubMed Abstract | Google Scholar
12. Mattii M, Ayala F, Balato N, Filotico R, Lembo S, Schiattarella M, et al. The balance between pro- and anti-inflammatory cytokines is crucial in human allergic contact dermatitis pathogenesis: the role of IL-1 family members. Exp Dermatol. (2013) 22:813–9. doi: 10.1111/exd.12272
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Dinarello CA., Interleukina-1 în patogeneza și tratamentul bolilor inflamatorii. Sânge (2011) 117: 3720-32. doi: 10.1182/sânge-2010-07-273417
PubMed Abstract | CrossRef Textul Complet | Google Scholar
16. Lembo S, Caiazzo G, Balato N, Monfrecola G, V Patra, Lupul P, et al. Erupție ușoară polimorfă și membrii familiei IL-1: orice diferență cu dermatita de contact alergică? Photochem Photobiol Sci. (2017) 16:1471–9. doi: 10.,1039/c7pp00142h
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Balato A, Schiattarella M, Lembo S, Mattii M, Prevete N, Balato N, et al. Interleukin-1 family members are enhanced in psoriasis and suppressed by vitamin D and retinoic acid. Arch Dermatol Res. (2013) 305:255–62. doi: 10.1007/s00403-013-1327-8
PubMed Abstract | CrossRef Full Text | Google Scholar
19., Borkowski AW, Kuo IH, Bernard JJ, Yoshida T, Williams dl, Hung NJ. Activarea receptorului 3 similar cu taxa este necesară pentru repararea normală a barierei pielii după deteriorarea UV. J. Invest Dermatol. (2015) 135:569–78. doi: 10.1038 / jid.2014.354
PubMed Abstract | CrossRef Textul Complet | Google Scholar
20. Li N, Yamasaki K, Saito R, Fukushi-Takahashi S, Shimada-Omori R, Asano M, și colab. Alarmin funcție de cathelicidin peptida antimicrobiană LL37 prin IL-36γ inducție umane keratinocitelor epidermice. J Immunol., (2014) 193:5140–8. doi: 10.4049/jimmunol.1302574
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Patra V, Wolf P. Microbial elements as the initial triggers in the pathogenesis of polymorphic light eruption? Exp Dermatol. (2016) 25:999–1001. doi: 10.1111/exd.13162
PubMed Abstract | CrossRef Full Text | Google Scholar
22., Gläser R, Navid F, Schuller W, Jantschitsch C, Harder J, Schröder JM și colab. Radiația UV-B induce expresia peptidelor antimicrobiene în keratinocitele umane in vitro și in vivo. J Alergie Clin Immunol. (2009) 123:1117–23. doi: 10.1016 / j.jaci.2009.01.043
PubMed Abstract | CrossRef Textul Complet | Google Scholar
23. Patru V, Mayer G, Gruber-Wackernagel A, Horn M, Lembo S, Wolf P., Profilul unic al expresiei peptidelor antimicrobiene în leziunile de erupție ușoară polimorfă în comparație cu pielea sănătoasă, dermatita atopică și psoriazisul. Fotodermatol Photoimmunol Photomed. (2018) 34:137–44. doi: 10.1111 / phpp.12355
PubMed Abstract | CrossRef Textul Complet | Google Scholar
25. Schweintzger NA, Gruber-lui wackernagel O, Shirsath N, Quehenberger F, Textier-Pietsch B, Lup P. Influența anotimpurilor pe nivelurile de vitamina D și de reglementare celule T la pacienții cu polimorfă lumina erupție., Photochem Photobiol Sci. (2016) 15:440–6. doi: 10.1039/c5pp00398a
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Proby C, Baker C, Morton O, Hawk JLM. New broad spectrum sunscreen for polymorphic light eruption. Lancet (1993) 341:1347–8.
PubMed Abstract | Google Scholar
28. Allas S, Lui H, Moyal D, Bissonnette R., Compararea capacității a 2 Protecții solare de a proteja împotriva erupției luminoase polimorfe induse de o lampă cu halogenuri metalice UV-a/UV-B. Arch Dermatol. (1999) 135:1421–2.
PubMed Abstract | Google Scholar
29. Ortel B, Wechdorn D, Tanew O, Honigsmann H. Efectul de nicotinamida pe phototest reacție în polimorfe lighteruption. Br J Dermatol. (1988) 118:669–73.
PubMed Abstract | Google Scholar
30., Caccialanza M, Percivalle S, Piccinno R, Brambilla R. Photoprotective activity of oral Polypodiumleucotomos extract in 25 patients with idiopathic photodermatoses. Photodermatol Photoimmunol Photomed. (2007) 23:46–7. doi: 10.1111/j.1600-0781.2007.00274.x
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Tanew A, Radakovic S, Gonzalez S, Venturini M, Calzavara-Pinton P. Oral administration of a hydrophilic extract of Polypodiumleucotomos for the prevention of polymorphic light eruption., J Am Acad Dermatol. (2012) 66:58–62. doi: 10.1016/j.jaad.2010.09.773
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Van Praag MCG Boom, BW, Vermeer BJ. Diagnosis and treatment of polymorphous light eruption. Int J Dermatol. (1994) 33:233–9.
Google Scholar
34. Ling TC, Clayton TH, Crawley J, Exton LS, Goulden V, Ibbotson S, et al., Asociația britanică a dermatologilor și liniile directoare ale grupului britanic de fotodermatologie pentru utilizarea sigură și eficientă a psoralen-ultraviolet a therapy 2015. Br J Dermatol. (2016) 174:24–55. doi: 10.1111 / bjd.14317
PubMed Abstract | CrossRef Textul Complet | Google Scholar
36. Man I, Dawe RS, Ferguson J. întărirea artificială pentru erupția luminii polimorfe: puncte practice din experiența de zece ani. Fotodermatol Photoimmunol Photomed. (1999) 15:3–4.,
PubMed Abstract | Google Scholar
37. Mastalier U, Kerl H, Wolf P. Clinical laboratory, phototest and phototherapy findings in polymorphic light eruptions: a retrospective study of 133 patients. Eur J Dermatol. (1998) 8:554–9.
PubMed Abstract | Google Scholar
38. Krutmann J, Morita A. Mechanisms of ultraviolet (UV) B and UVA phototherapy. J Invest Dermatol Symp Proc. (1999) 4:70–2.,
PubMed Abstract | Google Scholar
39. Janssens AS, Pavel S, Out-Luiting JJ, Willemze R, de Gruijl FR. Normalized ultraviolet (UV) induction of Langerhans cell depletion and neutrophil infiltrates after artificial UVB hardening of patients with polymorphic light eruption. Br J Dermatol. (2005) 152:1268–74. doi: 10.1111/j.1365-2133.2005.06690.x
PubMed Abstract | CrossRef Full Text | Google Scholar
40., Wolf P, Gruber-Wackernagel A, Bambach I, Schmidbauer U, Mayer G, Absenger M, et al. Fotohardeningul pacienților cu erupție ușoară polimorfă scade densitatea inițială a celulelor epidermice Langerhans, în timp ce crește numărul de celule mastocite în dermul papilar. Exp Dermatol. (2014) 23:428–30. doi: 10.1111 / exd.12427
PubMed Abstract | CrossRef Textul Complet | Google Scholar
42. Schwarz A, Navid F, Sparwasser T, Clausen BE, Schwarz T., 1,25-dihydroxyvitamin D exerts similar immunosuppressive effects as UVR but is dispensable for local UVR-induced immunosuppression. J Invest Dermatol. (2012) 132, 2762–9. doi: 10.1038/jid.2012.238
PubMed Abstract | CrossRef Full Text | Google Scholar
43. Norris PG, Hawk JL. Successful treatment of severe polymorphous light eruption with azathioprine. Arch Dermatol. (1989) 125:1377–9.
PubMed Abstract | Google Scholar