krótkie podsumowanie procesu Habera
proces Habera łączy azot z powietrza z wodorem otrzymywanym głównie z gazu ziemnego (metanu) w amoniak. Reakcja jest odwracalna, a produkcja amoniaku jest egzotermiczna.,
![]()
![]()
schemat przepływu dla procesu Haber wygląda następująco:
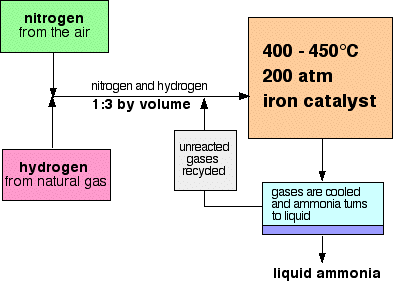
kilka uwag na temat warunków
katalizator
katalizator jest faktycznie nieco bardziej skomplikowany niż czyste żelazo. Jako promotor dodaje się do niego wodorotlenek potasu-substancję zwiększającą jego skuteczność.
ciśnienie
ciśnienie zmienia się w zależności od zakładu produkcyjnego, ale zawsze jest wysokie. Na egzaminie 200 atmosfer nie można się pomylić.,
Recykling
przy każdym przejściu gazów przez reaktor, tylko około 15% azotu i wodoru zamienia się w amoniak. (Liczba ta różni się również w zależności od rośliny.) Poprzez ciągły recykling nieaktywnego azotu i wodoru, całkowita konwersja wynosi około 98%.
wyjaśnienie warunków
proporcje azotu i wodoru
mieszanina azotu i wodoru wchodząca do reaktora ma stosunek 1 objętości azotu do 3 objętości wodoru.,
Prawo Avogadro mówi, że równe objętości gazów w tej samej temperaturze i ciśnieniu zawierają jednakową liczbę cząsteczek. Oznacza to, że gazy trafiają do reaktora w stosunku 1 cząsteczki azotu do 3 wodoru.
to jest proporcja wymagana przez równanie.
w niektórych reakcjach można użyć nadmiaru jednego z reagentów. Zrobiłbyś to, jeśli szczególnie ważne jest, aby zużywać jak najwięcej drugiego reagenta-jeśli, na przykład, był znacznie droższy. To nie ma zastosowania w tym przypadku.,
zawsze można użyć czegoś innego niż proporcje równania. Jeśli masz nadmiar jednego reagenta, przez reaktor przechodzą cząsteczki, które nie mogą reagować, ponieważ nie mają z czym reagować. To marnuje przestrzeń reaktora-szczególnie przestrzeń na powierzchni katalizatora.
temperatura
względy równowagi
aby uzyskać maksymalną możliwą ilość amoniaku w mieszaninie równowagi, należy przesunąć położenie równowagi w miarę możliwości w prawo.,
reakcja przednia (produkcja amoniaku) jest egzotermiczna.
![]()
![]()
zgodnie z zasadą Le Chateliera będzie to korzystne, jeśli obniżysz temperaturę. System zareaguje przesuwając pozycję równowagi, aby temu przeciwdziałać – innymi słowy, wytwarzając więcej ciepła.
aby uzyskać jak najwięcej amoniaku w mieszaninie równowagowej, potrzebujesz jak najniższej temperatury. Jednak 400 – 450°c nie jest niską temperaturą!,
rozważania dotyczące szybkości
im niższa temperatura, tym wolniejsza staje się reakcja. Producent stara się produkować jak najwięcej amoniaku dziennie. Nie ma sensu próbować osiągnąć mieszaninę równowagi, która zawiera bardzo wysoki udział amoniaku, jeśli trwa kilka lat dla reakcji, aby osiągnąć tę równowagę.
gazy muszą osiągnąć równowagę w bardzo krótkim czasie, w którym będą miały kontakt z katalizatorem w reaktorze.,
kompromis
400 – 450°C to kompromisowa temperatura wytwarzająca stosunkowo wysoki udział amoniaku w mieszaninie równowagowej (nawet jeśli wynosi tylko 15%), ale w bardzo krótkim czasie.
ciśnienie
rozważania dotyczące równowagi
![]()
![]()
zauważ, że po lewej stronie równania znajdują się 4 cząsteczki, ale tylko 2 po prawej.,
zgodnie z zasadą Le Chateliera, jeśli zwiększysz ciśnienie, układ zareaguje sprzyjając reakcji, która produkuje mniej cząsteczek. To spowoduje, że ciśnienie znowu spadnie.
aby uzyskać jak najwięcej amoniaku w mieszaninie równowagowej, potrzebujesz jak najwyższego ciśnienia. 200 atmosfer to wysokie ciśnienie, ale nie zadziwiająco wysokie.
zwiększenie ciśnienia zbliża cząsteczki do siebie., W tym konkretnym przypadku zwiększy to ich szanse na trafienie i przyklejenie się do powierzchni katalizatora, gdzie mogą zareagować. Im wyższe ciśnienie, tym lepiej pod względem szybkości reakcji gazowej.
względy ekonomiczne
aby wytrzymać bardzo wysokie ciśnienie, trzeba zbudować wyjątkowo mocne rury i zbiorniki zabezpieczające. Zwiększa to koszty kapitałowe podczas budowy zakładu.
wysokie ciśnienia kosztują wiele produkcji i konserwacji., Oznacza to, że koszty eksploatacji instalacji są bardzo wysokie.
kompromis
2008 jest kompromisem wybranym ze względów ekonomicznych. Jeśli stosowane ciśnienie jest zbyt wysokie, koszt jego wytworzenia przekracza cenę, którą można uzyskać za dodatkowy wytwarzany amoniak.
katalizator
względy równowagi
katalizator nie ma żadnego wpływu na położenie równowagi. Dodanie katalizatora nie wytwarza większego procentu amoniaku w mieszaninie równowagi. Jego jedyną funkcją jest przyspieszenie reakcji.,
rozważania o szybkości
w przypadku braku katalizatora reakcja jest tak powolna, że praktycznie żadna reakcja nie zachodzi w rozsądnym czasie. Katalizator zapewnia, że reakcja jest wystarczająco szybka, aby dynamiczna równowaga została ustawiona w bardzo krótkim czasie, że gazy są rzeczywiście w reaktorze.
oddzielanie amoniaku
gdy gazy opuszczają reaktor, są gorące i pod bardzo wysokim ciśnieniem., Amoniak jest łatwo skroplony pod ciśnieniem, o ile nie jest zbyt gorący, a więc temperatura mieszaniny jest obniżana na tyle, aby amoniak zamienił się w ciecz. Azot i wodór pozostają jako gazy nawet pod tak wysokim ciśnieniem i mogą być poddane recyklingowi.
pytania, aby sprawdzić swoje zrozumienie
Jeśli jest to pierwszy zestaw pytań, które zrobiłeś, przeczytaj stronę wprowadzającą przed rozpoczęciem. Musisz użyć przycisku Wstecz w przeglądarce, aby wrócić tutaj później.,
pytania dotyczące procesu Habera
odpowiedzi
gdzie chciałbyś teraz pojechać?
do menu równowaga . . .
do menu Chemia Fizyczna . . .
do Menu Głównego . . .