atomy i energia światła
badanie atomów i ich właściwości nakładają się na kilka różnych nauk. Chemicy, fizycy i astronomowie muszą zrozumieć skalę mikroskopową, w której funkcjonuje większość wszechświata, aby zobaczyć „większy obraz”.,
wewnątrz atomu
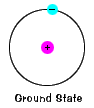 |
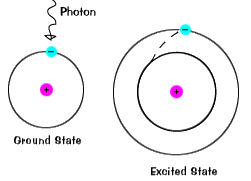
stan uziemienia elektronu, poziom energii, który zajmuje, jest stanem najniższej energii dla tego elektronu. |
| istnieje również maksymalna energia, że każdy elektron może mieć i nadal być częścią swojego atomu. Poza tą energią elektron nie jest już związany z jądrem atomu i uważa się, że jest zjonizowany., | 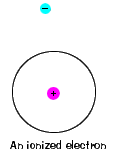 |
| gdy elektron chwilowo zajmuje stan energetyczny większy niż jego stan, jest w wzbudzonym state.An elektron może stać się wzbudzony, jeśli otrzymuje dodatkową energię, na przykład jeśli wchłania Foton lub pakiet światła, lub zderza się z pobliskim atomem lub cząstką. |
energia światła
ilustracje na tej stronie to oczywiście uproszczone wersje prawdziwych atomów. Rzeczywiste Atomy, nawet stosunkowo proste, jak wodór, mają wiele różnych orbitali, a więc istnieje wiele możliwych energii z różnymi stanami początkowymi i końcowymi., Gdy atom znajduje się w wzbudzonym stanie, elektron może spaść aż do stanu gruntu za jednym zamachem lub zatrzymać się na drodze na poziomie pośrednim.
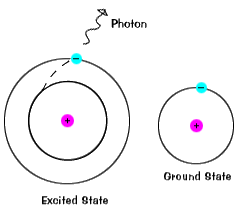 |
elektrony nie pozostają w Stanach wzbudzonych przez bardzo długi czas – wkrótce powracają do stanu podłoża, emitując Foton o tej samej energii, co ten, który został wchłonięty., |
identyfikacja poszczególnych typów atomów
przejścia między różnymi orbitalami są unikalne dla każdego elementu, ponieważ poziomy energii są jednoznacznie określone przez protony i neutrony w jądrze. Wiemy, że różne pierwiastki mają różną liczbę protonów i neutronów w jądrach. Kiedy elektrony pewnego atomu wracają do niższych Orbit ze stanów wzbudzonych, emitowane przez nie fotony mają Energie charakterystyczne dla tego rodzaju atomu., Daje to każdemu elementowi unikalny odcisk palca, umożliwiając identyfikację pierwiastków obecnych w zbiorniku gazu, a nawet gwiazdy.
możemy użyć narzędzi, takich jak układ okresowy pierwiastków, aby dowiedzieć się dokładnie, ile protonów, a tym samym elektronów, atom ma. Przede wszystkim wiemy, że aby atom miał ładunek neutralny, musi mieć taką samą liczbę protonów i elektronów. Jeśli atom traci lub zyskuje elektrony, staje się naładowany lub naładowany. Układ okresowy da nam liczbę atomową pierwiastka. Liczba atomowa mówi nam, ile protonów Atomy., Na przykład Wodór ma liczbę atomową jednego-co oznacza, że ma jeden proton, a więc jeden elektron – i faktycznie nie ma neutronów.
dla ucznia
na podstawie poprzedniego opisu atomu narysuj model atomu wodoru. „Standardowy” model atomu jest znany jako model Bohra.
różne formy tego samego pierwiastka chemicznego, które różnią się tylko liczbą neutronów w jądrze, nazywane są izotopami. Większość pierwiastków ma więcej niż jeden naturalnie występujący izotop., Wiele innych izotopów zostało wyprodukowanych w reaktorach jądrowych i laboratoriach naukowych. Izotopy zwykle nie są zbyt stabilne i ulegają rozpadowi promieniotwórczemu, dopóki nie powstaje coś bardziej stabilnego. Możesz być zaznajomiony z żywiołuranium-ma kilka niestabilnych izotopów, U-235 jest jednym z najbardziej znanych. 235 oznacza, że ta forma uranu ma łącznie 235 neutronów i protonów. Gdybyśmy sprawdzili liczbę atomową uranu i odjęli ją od 235, moglibyśmy obliczyć liczbę neutronów, które ma izotop.,
oto kolejny przykład – węgiel występuje zwykle w postaci C-12 (węgiel-12), czyli 6 protonów i 6 neutronów, choć jednym izotopem jest C-13, z 6 protonami i 7 neutronami.
dla ucznia
użyj układu okresowego i nazw pierwiastków podanych poniżej, aby dowiedzieć się, ile mają protonów, neutronów i elektronów.Narysuj model atomu następującego pierwiastka: krzem-28, magnez-24, Siarka-32, tlen-16 i hel-4.,
dla ucznia
za pomocą tekstu zdefiniuj następujące terminy: poziomy energii, absorpcja, emisja, stan wzbudzony, stan uziemienia, jonizacja, atom,pierwiastek, masa atomowa, liczba atomowa, izotop.
opcjonalna uwaga na temat mechanicznej Natury kwantowej atomówchociaż atom Bohr opisany powyżej jest miłym sposobem, aby dowiedzieć się o strukturze atomów, nie jest to najbardziej dokładny sposób ich modelowania., chociaż każdy orbital ma dokładną energię, elektron jest teraz wyobrażany jako rozmazany w „obłoku elektronowym”otaczającym jądro. Często mówi się o średniej odległości do chmury jako promienia elektronu orbit.So pamiętaj tylko, że słowa „Orbita” i „orbital” zachowamy, choć nie używamy ich do opisania nie płaskiej płaszczyzny orbitalnej, ale w której elektron ma prawdopodobieństwo istnienia. elektrony są trzymane w pobliżu jądra przez przyciąganie elektryczne między jądrem a elektronami.,Trzymane tam w ten sam sposób, że dziewięć planet pozostaje w pobliżu Słońca, a nie w galaktyce. W przeciwieństwie do układu słonecznego, gdzie orbity wszystkich planet znajdują się na tej samej płaszczyźnie, orbity elektronów są bardziej trójwymiarowe. Każdy poziom energii na atomie ma inny kształt. Istnieją równania matematyczne, które mówią o prawdopodobieństwie położenia elektronu na tej orbicie. rozważmy atom wodoru, którego już narysowaliśmy model Bohra.,
tekst i obrazy w tej sekcji zostały zaadaptowane ze strony Dave ' a Slavena na atomie (Patrz Referencje poniżej). |