wprowadzenie
zimą czasami dermatolodzy przyjmują bezobjawowych pacjentów, bez specyficznych zmian innych niż, być może, niektóre przebarwienia pozapalne, ale z desperacką potrzebą pomocy. Zaczynają opowiadać historię wielu grudek lub pęcherzyków pojawiających się na skórze po pierwszej intensywnej ekspozycji na słońce w roku., Wraz ze zmianami chorobowymi zaczyna się straszny swędzenie i wzrasta wraz z rozprzestrzenianiem się choroby, po następnej ekspozycji na słońce, czasami pogarszającej się przez rodzaj pieczenia. Niemniej jednak ludzie ci są modelowymi poszukiwaczami słońca i nadal cieszą się słońcem przez całe lato, czekając, aż grudki stopniowo zanikną i znikną. Główne pytania to: jak Mogę temu zapobiec? Dlaczego mam ten problem od ” 5 ” lat, ale nigdy wcześniej go nie miałem?,
najpewniej mamy do czynienia z polimorficzną erupcją światła (PLE) i zgodnie z życzeniami naszych pacjentów badania medyczne koncentrują się głównie na strategiach profilaktycznych, które obecnie stają się całkiem zadowalające. Z drugiej strony drugie i na pewno mniej zbadane pytanie pozostaje niejasne, chyba że do tej skomplikowanej układanki dodano wiele elementów. Celem tego krótkiego przeglądu jest wznowienie najnowszych osiągnięć w mechanizmach PLE i najczęściej stosowanych protokołów zapobiegania lub leczenia.
Patofizjologia polimorficznej erupcji światła: Co nowego?,
PLE jest najczęstszym zaburzeniem światłoczułym, charakteryzującym się przerywaną erupcją bez blizn świądowych grudek rumieniowych, pęcherzyków lub płytek (ryc. 1), które rozwijają się w ciągu kilku godzin od ekspozycji na promieniowanie ultrafioletowe (UVR) skóry pacjenta. Choroba jest zależna od podatności genetycznej, a także składników środowiskowych, takich jak rodzaj ekspozycji. PLE wydaje się gromadzić w rodzinach: szacuje się, że częstość występowania ple wynosiła odpowiednio 21 i 18% u bliźniąt monozygotycznych i dizygotycznych (1)., Ponadto, dodatnia historia rodzinna PLE u krewnych pierwszego stopnia była obecna u 12% dotkniętych par bliźniaczych w stosunku do 4% nienaruszonych par bliźniaczych (p < 0,0001). Konkordancja probandwise w monozygotycznych była lepsza niż w dizygotycznych parach bliźniaczych (odpowiednio 0,72 vs 0,30), wykazując silny efekt genetyczny (1). Wiele genów o potencjalnym zainteresowaniu patogenezą PLE zostało zbadanych z ogólnie niezadowalającymi wynikami., Korzystając z analizy segregacji, oszacowano, że 72% populacji Wielkiej Brytanii nosi allel pleasure o niskiej penetracji (2).
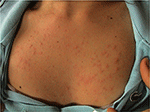
Rysunek 1. Obraz kliniczny polimorficznej erupcji światła u młodej kobiety.
niepowodzenie apoptozy: możliwe Fotoindukowane antygeny Neo
w niedawnej analizie ekspresji genomu tylko 16 genów uległo zróżnicowanej ekspresji pomiędzy ple i zdrowymi kontrolami po napromieniowaniu UV w odniesieniu do kontroli (3)., Spośród tych genów 14 wykazywało niższą ekspresję u pacjentów z PLE, podczas gdy dwa powodowały nadmierną ekspresję. Wśród 14 genów o niższej ekspresji w PLE są: podjednostka dopełniacza 1s (C1s), receptor zmiatacza B1 (SCARB1) fibronektyna (FN1), immunoglobulina członek nadrodziny 3 (IGSF3), kaspaza-1 (CASP1) i paraoksonaza 2 (PON2), wszystkie geny związane z apoptotycznym klirensem komórkowym. Przypuszcza się, że modyfikacja białka podczas apoptotycznego klirensu komórkowego może prowadzić do potencjalnego powstawania antygenu (4)., Następnie, zmniejszona ekspresja u pacjentów z PLE genów związanych z tym procesem może stanowić możliwe źródło autoagresji, jak również kluczową fazę w inicjacji procesu autoimmunologicznego, który promuje chorobę (3). Zgodnie z tymi ustaleniami, Kuhn et al. wykazano kumulację komórek apoptotycznych u pacjentów z PLE napromieniowanych minimalną dawką rumienia (med) UVB lub 60-100 J / cm2 UVA1 w porównaniu z grupą kontrolną (5).,
odporność: niepowodzenie tolerancji
Auto-antygeny wynikające z nieefektywnego klirensu komórek apoptotycznych, są prawdopodobnie pobierane przez komórki dendrytyczne (DCs) i prezentowane naiwnym limfocytom T (cytotoksycznym i pomocniczym), a następnie przekształcane w samoczynne limfocyty T (6, 7). Ta częściowa niewydolność apoptozy przyczynia się, wraz z niewystarczającą immunosupresją po ekspozycji na promieniowanie UV, do rozpoznawania i prezentacji antygenu, prowadząc do objawu klinicznego typowego dla pacjentów z PLE (8)., Rzeczywiście, niepowodzenie normalnej immunosupresji indukowanej przez UVR zostało udowodnione jako główna nieprawidłowość immunologiczna w PLE, wyjaśniana początkowo przez trwałość komórek Langerhansa (LCs) w naskórku. Ta nadmierna aktywacja układu odpornościowego, która ucieka do funkcjonalnej tolerancji indukowanej promieniowaniem UV, jest prawdopodobnie odpowiedzialna za zmniejszenie częstości występowania raka skóry u pacjentów z PLE (9). Z drugiej strony ten sam mechanizm jest winny niepowodzenia tłumienia alergicznego kontaktowego zapalenia skóry (ACD) po ekspozycji na UVR (10).,
szlak zapalny: reakcja nadwrażliwości typu opóźnionego
mechanizmy immunologiczne zaangażowane w PLE, z mediatorami wrodzonego i adaptacyjnego układu odpornościowego, są bardzo podobne, zarówno z histologicznego, jak i biochemicznego punktu widzenia, do ACD. W efekcie na początku lat siedemdziesiątych Epstein po raz pierwszy wskazał PLE jako reakcję nadwrażliwości typu opóźnionego (DTHR) na niezdefiniowany antygen skórny indukowany przez UVR (11). Ostatnio, aby wzmocnić tę koncepcję, niektóre z mediatorów zapalnych zaangażowanych w ACD wykazano również w PLE., Na przykład rodzina IL-1 (12, 13), rosnąca grupa cytokin, które odgrywają kilka ról w regulacji immunologicznej i zapaleniu (14), zaangażowana również w patogenezę ACD (12, 15), została zbadana również w PLE (16). IL – 36α i IL-36γ, prozapalnych członków rodziny IL-1 były zwiększone w ple w odniesieniu do kontroli, jak w przypadku próbek ACD, ale IL-36γ był znacznie zwiększony w PLE niż w ACD (16). Działając poprzez wspólny receptor złożony z IL-36R i IL-1R/AcP (IL-1RL2), IL-36α, IL-36β i IL-36γ aktywują NF-kB i MAPKs, promując reakcje zapalne., Wzrost IL-36S w skórze i krwi obwodowej pacjentów z PLE wskazuje na aktywację lokalnej i ogólnoustrojowej odpowiedzi immunologicznej, jak stwierdzono w wielu stanach zapalnych skóry (15, 17, 18). Prawdopodobnie związek między il-36S i ekspozycją na UVR jest reprezentowany przez parakrynowy prozapalny sygnał aktywacji receptora toll like (TLR) -3, spowodowany uwalnianiem RNA przez nekrotyczne keratynocyty (19). Rzeczywiście, awaria apoptotycznego klirensu w PLE, z obfitością szczątków komórkowych, może być odpowiedzialna za wzmocnienie tego ” sygnału alarmowego.,”
ponadto IL-36 może przyczynić się do wzmocnienia wrodzonego sygnału immunologicznego i wynikającej z tego kaskady zapalnej, promując peptydy przeciwbakteryjne (AMPs) (20).
szlak zapalny: AMPs i mikrobiom
w dużej mierze badane w wielu procesach zapalnych skóry, mediatory te, nazwane defensynami (α i β), katelicydyną (LL37), rybonukleazą 7 (RNase7) i psoriasyną (S100A7), w świetle nierównowagi wywołanej przez UVR na keratynocytach i mikrobiomie skóry, były również badane w PLE (21, 22). Patra i in., stwierdzono, że ekspresja łuszczycy, RNase7, HBD-2 I LL-37 była zwiększona w skórze LESIONALNEJ, podczas gdy HBD-3 była zmniejszona. Biorąc pod uwagę powierzchnię skóry jako „Wieloetniczny świat”, nie zapominając o kluczowej roli keratynocytów, nie możemy wykluczyć, że uwalnianie AMPs może być określone przez modyfikację składników mikrobiomu po interakcji UV (23). Rzeczywiście, mikrobiom może stanowić źródło, bezpośrednie lub pośrednie, jeszcze niewykrytych antygenów indukowanych UVR u pacjentów z PLE, co prowadzi do uszkodzenia keratynocytów., W konsekwencji LL-37, również indukowany przez UVB, IFNy, TNF-α, IL-6, może stanowić potencjalny pośredni czynnik ple (23). Może tworzyć Agregaty z samonukleinowymi kwasami zdolnymi do aktywacji PDC: w łuszczycy został uznany za główny autoantygen (24). Chociaż u pacjentów z PLE stwierdzono całkowity brak PDC (25), istnieje środowisko autoimmunologiczne, a LL-37 może odgrywać kluczową rolę, indukując inne szlaki zapalne. Na rysunku S1 (materiał uzupełniający), pojęcia wyrażone powyżej są wizualizowane w kreskówce.
terapia polimorficznej erupcji światła: Co nowego?,
pierwsza linia leczenia PLE obejmuje unikanie słońca, filtry przeciwsłoneczne i miejscowe kortykosteroidy (26). Dla wszystkich pacjentów postępowanie profilaktyczne jest fundamentalne podczas słonecznej pogody, poprzez unikanie intensywnej ekspozycji na promieniowanie UVR i używania odzieży ochronnej, a także stosowania ochrony przeciwsłonecznej, w szczególności podczas pierwszej ekspozycji w roku. Filtry nowej generacji o szerokim spektrum działania, o wysokim współczynniku ochrony przed słońcem dla UVB (SPF), w połączeniu z ochroną UVA o dłuższej długości fali, zapewniają całkowitą lub częściową ochronę nawet u 90% pacjentów z PLE (27, 28)., Stosowanie doustnych przeciwutleniaczy i nikotynamidu może stanowić dodatkowy ważny środek zapobiegawczy dla tych pacjentów. Korzystne działanie nikotynamidu badano w niekontrolowanym badaniu z udziałem 42 pacjentów, w którym 60% z nich zgłosiło całkowite zniesienie objawów podczas przyjmowania 2-3 g nikotynamidu na dobę przed ekspozycją na słońce (29). Ponadto wykazano, że ekstrakt z paproci tropikalnej Polypodiumleucotomos [PL] wykazuje zarówno silne działanie przeciwutleniające, jak i immunomodulujące., Po podaniu w dawce 480 mg / dobę przed ekspozycją na słońce znacznie zmniejszało reakcje skórne i objawy subiektywne (30, 31). Jeśli chodzi o miejscowe kortykosteroidy, nawet jeśli nie przeprowadzono badań w celu określenia ich skuteczności w PLE, są one szeroko stosowane w celu zmniejszenia swędzenia (26). Druga linia leczenia PLE obejmuje ogólnoustrojowe kortykosteroidy i terapię foto (chemią) (26). W randomizowanym, podwójnie ślepym, kontrolowanym placebo badaniu (32) autorzy zasugerowali stosowanie 25 mg prednizolonu na dobę przez 4-5 dni na początku erupcji., Chociaż należy wziąć pod uwagę potencjalne długoterminowe skutki uboczne powtarzających się kursów prednizolonu, można go zalecić pacjentom, którzy cierpią na sporadyczne ataki PLE, w przypadku braku przeciwwskazań. W łagodniejszych przypadkach PLE wystarczający może być program samo kondycjonowania polegający na ekspozycji absolwentów na światło słoneczne w okresie wiosennym (33). Mając na uwadze, w cięższych przypadkach, medycznie nadzorowane leczenie kondycjonowania / odczulania może być bardziej odpowiednie., Skuteczna może być również terapia psoralen i UVA (PUVA), fototerapia wąskopasmowa (NB)-UVB lub szerokopasmowa (BB)-UVB, zwykle podawana wczesną wiosną (26). Protokół leczenia zazwyczaj składa się z jednego cyklu fototerapii / fotochemioterapii w ciągu 5-6 tygodni. Dawki początkowe zależą od minimalnej dawki rumieniowej (MED) lub minimalnej dawki fototoksycznej (MPD) i często stanowią 50-70% tych mierzonych progów z narastającym wzrostem., Aby utrzymać korzyści uzyskane dzięki terapii odczulającej, zaleca się regularną ekspozycję na słońce przez całe lato, w przeciwnym razie hartowanie może zostać utracone w ciągu 4-6 tygodni. W leczeniu PLE należy preferować NB-UVB niż PUVA (moc zalecenia D; poziom dowodów 4), ze względu na mniejsze ryzyko fotokarcynogenezy, brak ryzyka nudności lub innych działań niepożądanych związanych ze spożyciem mopa i brak konieczności stosowania ochrony oczu po leczeniu. Jednak PUVA należy rozważyć, przed innymi metodami leczenia ogólnoustrojowego, jeśli NB-UVB nie powiodło się lub wcześniej wywołało erupcję., W efekcie, jak opisano poniżej, udowodniono skuteczność wielu schematów fototerapii (BB-UVB, NB-UVB i PUVA), a działania niepożądane, pod względem prowokacji wysypki, rumienia i swędzenia były częstsze w przypadku UVB niż w przypadku PUVA (34). Jak podsumowano, w literaturze skuteczność PUVA daje 65-100% wskaźnik fotoprotekcji (34)., Przeprowadzono wiele badań porównawczych, ale w jedynym randomizowanym kontrolowanym badaniu pomiędzy PUVA I NB-UVB oraz tabletkami placebo, trzy razy w tygodniu, przez 5 tygodni, nie stwierdzono znaczącej różnicy w skuteczności, biorąc pod uwagę występowanie ple lub ograniczenia aktywności na świeżym powietrzu (35). W przeglądzie retrospektywnym 10 lat, zgłoszonym przez Man et al. (36), 170 pacjentów z umiarkowanym do ciężkiego PLE otrzymało fototerapię PUVA i (lub) UVB. Szczegółowo, 8 pacjentów otrzymało PUVA, 128 NB-UVB, 5 BB-UVB, a 29 pacjentów, u których nie uzyskano zadowalającej odpowiedzi na NB-UVB, otrzymało PUVA w następnym roku., Przeprowadzono samoocenę nasilenia, a częstość występowania epizodów PLE zgłaszano podczas wizyt kontrolnych jesienią lub wiosną następnego roku. Dobrą lub umiarkowaną poprawę odnotowano u 88% pacjentów leczonych PUVA oraz u 89% pacjentów otrzymujących UVB. Spośród pacjentów leczonych zarówno PUVA, jak i NB-UVB, większość preferowała PUVA. W innym 14-letnim badaniu retrospektywnym z udziałem 79 pacjentów leczonych fototerapią (37), skuteczność, mierzona w okresie następnego lata w okresie fotoprotekcji z całkowitą / częściową remisją, wynosiła 65% dla PUVA, 82% dla BB-UVB i 83% dla samego UVA., W tym przypadku leczenie PUVA było zarezerwowane dla cięższych postaci PLE.
mechanizmy, za pomocą których fototerapia indukuje fotoprotekcję, nie są w pełni poznane.
jednak w ostatnich latach dokonano wielu postępów. Oprócz dobrze znanego wpływu fototerapii na melaninizację i zagęszczanie naskórka, opisano szeroki zakres właściwości immunomodulujących i przeciwzapalnych indukowanych promieniowaniem UV (38)., Zarówno UVB, jak i UVA modulują ekspresję cząsteczki adhezji i indukują rozpuszczalne mediatory, takie jak hormon stymulujący a-melanocyty, IL-10 (który hamuje wytwarzanie interferonu γ) i prostaglandyna E2, które wykazują działanie przeciwzapalne, zapobiegając aktywacji komórek T i promując apoptozę naciekających komórki T skóry (34). Ponadto wykazano, że profilaktyczne fotohardenowanie UV u pacjentów z PLE przywraca wywołaną promieniowaniem UV migrację LC z naskórka do węzłów chłonnych drenujących skórę: jedno z kluczowych zdarzeń komórkowych w immunosupresji UV (39)., Tolerancja indukowana przez LC jest pośredniczona w uwalnianiu cytokin immunosupresyjnych, takich jak IL-10, oraz w interferencji z dojrzewaniem i indukcją limfocytów T regulatorowych (Treg) (40). Ponadto ostatnio odnotowano ciekawy związek między LC, Tregami i witaminą D3. Rzeczywiście Wykazano, że krótkotrwałe, tygodniowe miejscowe leczenie wstępne analogiem 1,25-dihydroksywitaminy D, kalcypotriolem, zmniejszyło objawy PLE po późniejszej fotoprowokacji eksperymentalnej (41)., Ponadto w badaniu na myszach 1,25-dihydroksywitamina D wykazywała porównywalne działanie immunosupresyjne jak UV (42). Wyróżniono kolejny interesujący przesłuch między LCs a komórkami tucznymi. Oprócz uznanej roli w atopii, komórki tuczne skóry są również odpowiedzialne za ochronę skóry przed zapaleniem wywołanym przez UVB, promując immunosupresję UV (40). Badania na ludziach wykazały, że po ostrej i przewlekłej ekspozycji na UVR, liczba komórek tucznych skóry wzrasta wraz z uwalnianiem IL-10., Ogólnie Dane te sugerują potencjalną rolę komórek tucznych w PLE oraz w mechanizmie fotohardeneracji. Zgodnie z tym, Wolf et al. zgłaszano po raz pierwszy, że fotohardenizacja znacznie zwiększa gęstość komórek tucznych w brodawkowatej skórze właściwej pacjentów z PLE (40). Podsumowując, fotohardening działa w PLE, przywracając normalny szlak immunologiczny UV tłumiący, z udziałem wielu typów komórek. Leczenie trzeciego rzutu dla PLE obejmuje stosowanie ogólnoustrojowych leków immunosupresyjnych, takich jak azatiopryna i cyklosporyna., W literaturze opisano jednak tylko sporadyczne przypadki pacjentów z powodzeniem leczonych (43, 44). Co więcej, hydroksychlorochina, kwasy tłuszczowe omega-3 i beta-karoten zostały zaproponowane jako leczenie, ale dalsze podwójnie ślepe, randomizowane kontrolowane badania w celu rzeczywistej oceny ich skuteczności klinicznej są wymagane.
wnioski
ponieważ wysoka częstość występowania i rosnąca częstość występowania PLE, związana z dyskomfortem i ograniczeniami stylu życia, konieczne są przyszłe badania, aby znaleźć nowe strategie terapeutyczne i / lub zapobiegawcze., Wybór odpowiedniego leczenia PLE wymaga dobrej znajomości indywidualnego przebiegu klinicznego choroby wraz z możliwością wykonania fototestu. Podkreślono kilka nowych aspektów możliwej aktywacji i promocji procesu zapalnego.,
do obecnego stanu wiedzy, pomimo identyfikacji niektórych kluczowych regulacji komórkowych zaangażowanych w przywrócenie tolerancji immunologicznej, trudno jest wyciągnąć konkretne wnioski na temat skuteczności różnych potencjalnych metod leczenia w PLE, ze względu na brak odpowiednich badań i trudności w ocenie miar wyniku. Ocena kliniczna do oceny stopnia nasilenia PLE (PLESI) (45) pozostaje instrumentem rzadko stosowanym i ogranicza się głównie do celów badawczych., Głębsze badanie podstawowych mechanizmów patogenetycznych zaburzenia pozwoli bardziej ukierunkowane podejście leczenia.
wkład autora
SL zaprojektował rękopis, wybrał materiał do pracy, napisał wstępny szkic i poprawił następujące szkice rękopisu. AR był zaangażowany w pisanie rękopisu, wspierając nowe idee treści i stylu.,
Oświadczenie o konflikcie interesów
autorzy oświadczają, że badanie zostało przeprowadzone w przypadku braku jakichkolwiek relacji handlowych lub finansowych, które mogłyby być interpretowane jako potencjalny konflikt interesów.
materiał uzupełniający
rysunek S1. Wzajemne oddziaływanie wrodzonego i adaptacyjnego układu odpornościowego w kontekście niepowodzenia apoptozy w naskórku. (Symbol zielony) łuszczyca: obfita ekspresja w kolczystych i ziarnistych warstwach skóry. (Symbol niebieski) rnase7: głównie wyrażone w keratynocytach warstwy ziarnistej i warstwy rogowej zmian plej., (Żółty symbol) LL – 37 był głęboko wyrażony w i wokół naczyń krwionośnych i gruczołów w PLE. (Symbol komórki fioletowej) apoptotyczne keratynocyty z nieefektywnym klirensem.,hic light eruption; ACD, Allergic contact dermatitis; DTHR, Delayed type hypersensitivity reaction; UVR, Ultraviolet radiation; C1s, Complement 1s subunit; SCARB1, Scavenger receptor B1; FN1, Fibronectin; IGSF3, Immunoglobulin superfamily member 3; CASP1, Caspase-1; PON2, Paraoxonase 2; MED, Minimal Erythema Dose; DCs, Dendritic cells; LCs, Langerhans cells; TLR, Toll like receptor; AMPs, Antimicrobial peptides; SPF, Sun protection factor; PUVA, Psoralen and UVA therapy; NB-UVB, Narrowband; BB-UVB, Broadband UVB; MPD, Minimum phototoxic dose; Tregs, Regulatory T cells; PL, Polypodiumleucotomos.,
2. McGregor JM, Grabczynska S, Vaughan R, Hawk JL, Lewis CM. Genetic modelling of abnormal photosensitivity in families with polymorphic light eruption and actinic prurigo. J Invest Dermatol. (2000) 115:471–6. doi: 10.1046/j.1523-1747.2000.00080.x
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Lembo S, Hawk JLM, Murphy GM, Kaneko K, Young AR, McGregor JM, et al., Aberrant gene expression with deficient apoptotic keratinocyte clearance may predispose to polymorphic light eruption. Br J Dermatol. (2017) 177:1450–3. doi: 10.1111/bjd.15200
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Savill J, Fadok V. Corpse clearance defines the meaning of cell death. Nature (2000) 407:784–8. doi: 10.,1038/35037722
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Kuhn A, Herrmann M, Kleber S, Beckmann-Welle M, Fehsel K, Martin-Villalba A, et al. Accumulation of apoptotic cells in the epidermis of patients with cutaneous lupus erythematosus after ultraviolet irradiation. Arthritis Rheum. (2006) 54:939–50. doi: 10.1002/art.21658
PubMed Abstract | CrossRef Full Text | Google Scholar
6., Savill J, Dransfield I, Gregory C, Haslett C. A blast from the past: clearance of apoptotic cells regulates immune responses. Nat RevImmunol. (2002) 2:965–75. doi: 10.1038/nri957
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Albert ML, Sauter B, Bhardwaj N. Dendritic cells acquire antigen from apoptotic cells and induce class I-restricted CTLs. Nature (1998) 392:86–9. doi: 10.,1038/32183
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Koulu LM, Laihia JK, Peltoniemi HH, Jansén CT. UV-induced tolerance to a contact allergen is impaired in polymorphic light eruption. J Invest Dermatol. (2010) 130:2578–82. doi: 10.1038/jid.2010.181
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Epstein JH. Polymorphous light eruption. J Am Acad Dermatol. (1980) 3:329–43.,
PubMed Abstract | Google Scholar
12. Mattii M, Ayala F, Balato N, Filotico R, Lembo S, Schiattarella M, et al. The balance between pro- and anti-inflammatory cytokines is crucial in human allergic contact dermatitis pathogenesis: the role of IL-1 family members. Exp Dermatol. (2013) 22:813–9. doi: 10.1111/exd.12272
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Dinarello CA., Interleukina-1 w patogenezie i leczeniu chorób zapalnych. Blood (2011) 117:3720-32.AVI podoba mi się! do obserwowanych nr: 101182-2010-07-273417
PubMed Abstract | CrossRef Full Text/Google Scholar
16. Lembo S, Caiazzo G, Balato N, Monfrecola G, Patra V, Wolf P, et al. Polimorficzna erupcja światła i członkowie rodziny IL-1: jakaś różnica z alergicznym kontaktowym zapaleniem skóry? Fotochem Fotobiol Sci. (2017) 16:1471–9. doi: 10.,1039/c7pp00142h
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Balato A, Schiattarella M, Lembo S, Mattii M, Prevete N, Balato N, et al. Interleukin-1 family members are enhanced in psoriasis and suppressed by vitamin D and retinoic acid. Arch Dermatol Res. (2013) 305:255–62. doi: 10.1007/s00403-013-1327-8
PubMed Abstract | CrossRef Full Text | Google Scholar
19., Borkowski AW, Kuo IH, Bernard JJ, Yoshida T, Williams MR, Hung NJ. Aktywacja receptora Toll-like 3 jest wymagana do normalnej naprawy bariery skóry po uszkodzeniu promieniami UV. J. Invest Dermatol. (2015) 135:569–78. podoba mi się! do obserwowanych nr: 1010382014.354
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Li N, Yamasaki K, Saito R, Fukushi-Takahashi S, Shimada-Omori R, Asano m, et al. Funkcja Alarmin katelicydyny peptydu przeciwbakteryjnego LL37 poprzez indukcję IL-36γ w ludzkich keratynocytach naskórkowych. J Immunol., (2014) 193:5140–8. doi: 10.4049/jimmunol.1302574
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Patra V, Wolf P. Microbial elements as the initial triggers in the pathogenesis of polymorphic light eruption? Exp Dermatol. (2016) 25:999–1001. doi: 10.1111/exd.13162
PubMed Abstract | CrossRef Full Text | Google Scholar
22., Gläser R, Navid F, Schuller w, Jantschitsch C, Harder J, Schröder JM, et al. Promieniowanie UV-B indukuje ekspresję peptydów przeciwbakteryjnych w ludzkich keratynocytach in vitro i In vivo. J Allergy Clin Immunol. (2009) 123:1117–23. podoba mi się! do obserwowanych nr: 610162009.01.043
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Patra V, Mayer G, Gruber-Wackernagel A, Horn M, Lembo S, Wolf P., Unikalny profil przeciwbakteryjnej ekspresji peptydów w polimorficznych zmianach erupcyjnych w porównaniu do zdrowej skóry, atopowego zapalenia skóry i łuszczycy. Photodermatol Photoimmunol Photomed. (2018) 34:137–44. podoba mi się! do obserwowanych nr: 1011112355
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Schweintzger NA, Gruber-Wackernagel a, Shirsath N, Quehenberger F, Obermayer-Pietsch B, Wolf P. Wpływ pór roku na poziom witaminy D i regulatorowe limfocyty T u pacjentów z polimorficzną erupcją światła., Photochem Photobiol Sci. (2016) 15:440–6. doi: 10.1039/c5pp00398a
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Proby C, Baker C, Morton O, Hawk JLM. New broad spectrum sunscreen for polymorphic light eruption. Lancet (1993) 341:1347–8.
PubMed Abstract | Google Scholar
28. Allas S, Lui H, Moyal D, Bissonnette R., Porównanie zdolności 2 filtrów przeciwsłonecznych do ochrony przed polimorficzną erupcją światła wywołaną przez lampę metalohalogenkową UV-A / UV-B. Arch Dermatol. (1999) 135:1421–2.
PubMed Abstract/Google Scholar
29. Ortel B, wechdorn D, Tanew A, Honigsmann H. wpływ nikotynamidu na reakcję fototestu w polimorficznym rozjaśnianiu. Br J Dermatol. (1988) 118:669–73.
PubMed Abstract/Google Scholar
30., Caccialanza M, Percivalle S, Piccinno R, Brambilla R. Photoprotective activity of oral Polypodiumleucotomos extract in 25 patients with idiopathic photodermatoses. Photodermatol Photoimmunol Photomed. (2007) 23:46–7. doi: 10.1111/j.1600-0781.2007.00274.x
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Tanew A, Radakovic S, Gonzalez S, Venturini M, Calzavara-Pinton P. Oral administration of a hydrophilic extract of Polypodiumleucotomos for the prevention of polymorphic light eruption., J Am Acad Dermatol. (2012) 66:58–62. doi: 10.1016/j.jaad.2010.09.773
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Van Praag MCG Boom, BW, Vermeer BJ. Diagnosis and treatment of polymorphous light eruption. Int J Dermatol. (1994) 33:233–9.
Google Scholar
34. Ling TC, Clayton TH, Crawley J, Exton LS, Goulden V, Ibbotson S, et al., British association of dermatologists and British photodermatology Group guidelines for the safe and effective use of psoralen-ultraviolet a therapy 2015. Br J Dermatol. (2016) 174:24–55. podoba mi się! do obserwowanych nr: 1011114317
PubMed Abstract | CrossRef Full Text | Google Scholar
36. Man I, Dawe RS, Ferguson J. sztuczne hartowanie dla polimorficznej erupcji światła: praktyczne punkty z dziesięcioletniego doświadczenia. Photodermatol Photoimmunol Photomed. (1999) 15:3–4.,
PubMed Abstract | Google Scholar
37. Mastalier U, Kerl H, Wolf P. Clinical laboratory, phototest and phototherapy findings in polymorphic light eruptions: a retrospective study of 133 patients. Eur J Dermatol. (1998) 8:554–9.
PubMed Abstract | Google Scholar
38. Krutmann J, Morita A. Mechanisms of ultraviolet (UV) B and UVA phototherapy. J Invest Dermatol Symp Proc. (1999) 4:70–2.,
PubMed Abstract | Google Scholar
39. Janssens AS, Pavel S, Out-Luiting JJ, Willemze R, de Gruijl FR. Normalized ultraviolet (UV) induction of Langerhans cell depletion and neutrophil infiltrates after artificial UVB hardening of patients with polymorphic light eruption. Br J Dermatol. (2005) 152:1268–74. doi: 10.1111/j.1365-2133.2005.06690.x
PubMed Abstract | CrossRef Full Text | Google Scholar
40., Wolf P, Gruber-Wackernagel A, Bambach I, Schmidbauer U, Mayer G, Absenger m, et al. Fotohardenizacja u pacjentów z polimorficzną erupcją światła zmniejsza wyjściową gęstość komórek Langerhansa naskórka, jednocześnie zwiększając liczbę komórek tucznych w brodawkowatej skórze właściwej. Exp Dermatol. (2014) 23:428–30. podoba mi się! do obserwowanych nr: 7111112427
PubMed Abstract | CrossRef Full Text | Google Scholar
42. Schwarz A, Navid F, Sparwasser T, Clausen BE, Schwarz T., 1,25-dihydroxyvitamin D exerts similar immunosuppressive effects as UVR but is dispensable for local UVR-induced immunosuppression. J Invest Dermatol. (2012) 132, 2762–9. doi: 10.1038/jid.2012.238
PubMed Abstract | CrossRef Full Text | Google Scholar
43. Norris PG, Hawk JL. Successful treatment of severe polymorphous light eruption with azathioprine. Arch Dermatol. (1989) 125:1377–9.
PubMed Abstract | Google Scholar