Nonvalvular Vorhofflimmern (NVAF) ist die am häufigsten vorkommende Arrhythmie in Spanien. Die Inzidenz hängt eng mit dem Alter zusammen, wobei die Prävalenz bei Patienten über 80 Jahren nahe bei 25% liegt.1 Unter den vielen mit NVAF verbundenen Prozessen ist ein zerebrovaskulärer Unfall kardioembolischen Ursprungs wahrscheinlich die schwerwiegendste Komplikation, da er zu hohen Behinderungs-und Sterblichkeitsraten führt.,2 Ein weiteres Problem im Zusammenhang mit Vorhofflimmern ist die Notwendigkeit einer oralen Antikoagulationstherapie (OAC), um kardioembolische Ereignisse zu verhindern. Dieses Bedürfnis wächst mit zunehmendem Alter, da das Risiko eines Ereignisses noch größer ist.1 Darüber hinaus steigt bei diesen Patienten auch das Risiko von Komplikationen im Zusammenhang mit einer Antikoagulationstherapie, insbesondere von Blutungen.3 Derzeit ist die perkutane linksatriale Anhängsel-Okklusion (LAA) eine Alternative für Patienten mit NVAF und Kontraindikationen für die OAC-Behandlung.,4,5
ORALE ANTIKOAGULATIONSTHERAPIE: WIRKSAMKEIT UND EINSCHRÄNKUNGEN
Die Antikoagulationstherapie mit Vitamin-K-Antagonisten gilt als Standardbehandlung für NVAF. Die Hauptprobleme bei diesen Medikamenten sind das erhöhte Blutungsrisiko, die Notwendigkeit regelmäßiger Untersuchungen, die Wechselwirkung mit Nahrungsmitteln oder anderen Medikamenten und in einigen Fällen die Instabilität der Arzneimittelwirkung. Es wird geschätzt, dass zwischen 30% und 50% der für OAC angegebenen Patienten diese nicht erhalten.6 Mit der Einführung neuer Antikoagulanzien wie Dabigatran, 7 Apixaban, 8 und Rivaroxaban könnte sich das 9-Management dieser Patienten ändern., Wie auch immer der Fall sein mag, trotz ihres stabileren und sichereren Aktionsprofils ist das Blutungsrisiko mit einer jährlichen Rate zwischen 2.1% und 3.6% weiterhin die wichtigste Achillesferse dieser neuen Wirkstoffe (Tabelle). In der Tat zeigen neuere Register, dass die Inzidenz von kardioembolischen Ereignissen und Blutungen nach Dabigatran denen von Warfarin ähnlich sein könnte.10 Trotz der Einführung neuer Antikoagulanzien bleibt der Prozentsatz der Patienten, die für OAC angezeigt sind, aber keine Behandlung erhalten, bei etwa 40%.,11 Angesichts der schlechten Einhaltung der Therapie und des anhaltenden Blutungsrisikos ist die Notwendigkeit von Alternativen zur Antikoagulationstherapie für diese Patienten zu einer Priorität geworden.
LINKER VORHOFANHANG: FUNKTION, ANATOMIE UND INDIKATIONEN FÜR DEN VERSCHLUSS
Die LAA ist ein embryologischer Überrest und ihre Hauptfunktion besteht darin, das Blutvolumen zu kontrollieren. Es befindet sich ganz in der Nähe der linken Circumflex-Arterie und grenzt auf der oberen Ebene an die obere linke Lungenvene und auf der unteren Ebene an die Mitralklappe., LAA Morphologie ist außerordentlich heterogen von einem Patienten zum anderen und es gibt oft mehr als einen Lappen. Im Sinusrhythmus ist die LAA eine kontraktile Struktur, die ihren Inhalt bei jedem Herzschlag entleert. Bei Vorhofflimmern verliert die LAA ihre Kontraktionsfähigkeit und erweitert sich, was zu einer Verlangsamung des Blutflusses führt, was zu einem erhöhten Thromboserisiko führt. In pathologischen Studien von Patienten mit NVAF werden 91% der Thromben im linken Vorhof in der LAA gefunden., Dies hat zu der Überzeugung geführt, dass eine perkutane LAA-Okklusion eine wirksame Strategie sein könnte, um ein kardioembolisches Risiko bei Patienten mit NVAF zu verhindern.
Die perkutane LAA-Okklusion befindet sich noch im Anfangsstadium und es müssen noch einige Jahre vergehen, bis wir eine zuverlässigere Sicht auf ihre Rolle bei Patienten mit NVAF gewinnen können. Auch wenn es in Zukunft eine echte Alternative für Patienten ohne Kontraindikationen für OAC darstellen könnte, sollte seine Anwendung derzeit Patienten mit Kontraindikationen für eine Antikoagulationstherapie vorbehalten sein, wie in europäischen Richtlinien (IIb-Indikation) empfohlen.,5 Tatsächlich werden die meisten Verfahren bei Patienten, die eine Antikoagulationstherapie erhalten, entweder vom neurologischen Dienst nach einer Episode intrakranieller Blutungen oder von der Gastroenterologie nach Beobachtung wiederkehrender Verdauungsblutungen ohne behandelbare Ursache überwiesen. Das Fehlen gültiger Alternativen zur OAC zur Verhinderung eines kardioembolischen Risikos, das im Allgemeinen hoch ist, da es sich typischerweise um ältere Patienten mit mehreren Pathologien handelt, macht die LAA-Okklusion zu einer sehr attraktiven Option für diese Patienten., Labiles internationales normalisiertes Verhältnis oder das Auftreten eines kardioembolischen Ereignisses trotz OAC-Behandlung und eines angemessenen internationalen normalisierten Verhältnisses sind andere Kontexte, in denen eine perkutane LAA-Okklusion gerechtfertigt sein könnte. In jedem Fall sind multidisziplinäre, individualisierte Entscheidungen erforderlich, um sowohl das kardioembolische als auch das Blutungsrisiko und andere wesentliche Faktoren wie die Wirksamkeit der Behandlung, die Gebrechlichkeit des Patienten oder die Einhaltung der Behandlung, insbesondere mit OAC, zu beurteilen.
PERKUTANE LINKSATRIALE ANHÄNGSEL-OKKLUSIONSVORRICHTUNGEN
Das PLAATO™ – Gerät war der erste perkutane LAA-Okkluder (Abb. 1)., Trotz guter vorläufiger Ergebnisse in Bezug auf Wirksamkeit und Sicherheit wurde das Entwicklungsprogramm ausgesetzt und das Gerät verschwand vom Markt.
Derzeit sind die beiden weltweit am häufigsten verwendeten Geräte das Watchman™ System (Boston Scientific; Boston, Massachusetts, USA) und der Amplatzer™ Cardiac Plug (ACP) (St. Jude Medical; Minneapolis, Minnesota, USA) (Abb. 1). Wie das PLAATO™ – System werden beide über einen transseptalen Weg unter Verwendung des femoralen Venenzugangs implantiert., Beide Prothesen sind hochflexibel und verfügen über ein System stabilisierender Führungsdrähte, die an der LAA-Wand verankern und so eine Embolisation vermeiden. Der Hauptunterschied zwischen den beiden Geräten liegt jedoch in ihrer Form. Das Watchman™ – System wird 10 mm vom LAA ostium entfernt implantiert und deckt es daher nicht ab; Das ACP enthält einen Lappen, der 10-15 mm vom Ostium implantiert wird, und eine Scheibe, die das LAA ostium vollständig bedeckt (Abb. 2). Ein ACP der zweiten Generation namens Amplatzer™ Amulet™ ist kürzlich auf den Markt gekommen. Das Amulett™ – Gerät (Abb., 1) ist auch lappenförmig und hat eine Scheibe wie die ACP, hat aber Modifikationen, die die Geräteherstellung und Implantation erleichtern und gleichzeitig das Risiko von Embolisation und Thrombose minimieren.
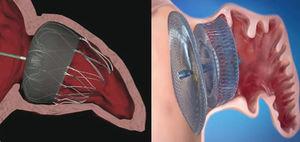
Position der Herzstopfengeräte Watchman™ und Amplatzer™ nach Implantation in den linken Vorhofanhang., Watchman™ – Gerät implantiert bei 10 mm vom Ostium des linken Vorhofsanhangs (links) und Amplatzer™ – Herzstopfengerät mit dem Lappen implantiert bei 10 mm vom Ostium und der Scheibe, die den Eingang zum linken Vorhofsanhangsanhangs (rechts) abdeckt.
Zahlreiche Register belegen die Wirksamkeit und Sicherheit des Watchman™-Systems und des ACP, aber beide erfordern eine nicht unerhebliche Lernkurve bei der Implantation., Die PROTECT AF-Studie, 12 die einzige randomisierte Studie, in der Warfarin mit LAA-Okklusion (Watchman™) bei Patienten mit NVAF verglichen wurde, zeigte, dass die LAA-Okklusion hinsichtlich des primären Ziels nicht weniger erfolgreich ist (kombinierter zerebrovaskulärer Unfall, systemische Embolie und kardiovaskulärer oder ungeklärter Tod), zeigte jedoch eine besorgniserregende Rate periproceduraler Ereignisse mit 4, 4% Inzidenz schwerer Perikardergüsse., Dieses anfängliche Problem wurde auf die Lernkurve des Operators zurückgeführt: Mit der Erfahrung des Operators sank die Komplikationsrate und der Prozentsatz erfolgreicher Implantationen verbesserte sich signifikant. Derzeit (für beide Geräte) sind mehr als 95% der Implantationen im Allgemeinen erfolgreich und die schwere Perikardergusionsrate beträgt
TECHNISCHE ÜBERLEGUNGEN
Die perkutane LAA-Okklusionstechnik erfordert ein Team mit Erfahrung in angeborenen/strukturellen Erkrankungen., Obwohl einige Gruppen nur intrakardiale Echokardiographie oder sogar angiographische Kontrolle verwenden, um das Verfahren zu leiten und Intubation des Patienten zu vermeiden, verwenden die meisten Zentren transösophageale Echokardiographie (TEE) unter Vollnarkose. Strukturell hat die LAA sehr feine Wände und eine heterogene Morphologie, die Mikrothrombosen vor dem TEE verbergen kann. Die Erfahrung des Bedieners ist unerlässlich, um Manipulationen innerhalb der LAA zu minimieren und somit das Risiko einer Perforation und periproceduralen Embolie zu verringern., Zwei der wichtigsten Faktoren, die die Manipulation in der LAA minimieren, sind die folgenden: a) eine niedrige hintere transseptale Punktion, die eine frontale Annäherung an die LAA erleichtert, und b) eine detaillierte Untersuchung der LAA, wenn möglich mit TEE und Angiographie, um die LAA-Morphologie festzustellen und genaue Maßnahmen zu erhalten, die die Auswahl der Okkludergröße erleichtern. Es wird empfohlen, Messungen bei normalem Blutvolumen durchzuführen, da die LAA-Größe in Abhängigkeit vom Feuchtigkeitsgehalt des Patienten erheblich variieren kann., Während des Eingriffs neigen die Patienten dazu, dehydriert zu werden; Daher wird empfohlen, den Druck im linken Vorhof zu bestimmen und Flüssigkeit zu verabreichen, um den >10 mmHg-Druck aufrechtzuerhalten, bevor Messungen durchgeführt werden.
Dies ist ein relativ neues Verfahren, und obwohl TEE der Bildgebungsstandard ist, bleibt der ideale Bildgebungsmodus unbekannt. Die LAA-Morphologie ist bei 80% der Patienten oval, daher variieren die Durchmesser normalerweise aufgrund der kurzen und langen Achsen. Dieser Unterschied kann bei 2-dimensionalen Bildgebungstechniken unbemerkt bleiben., Wie bei Verfahren wie dem perkutanen Aortenklappenersatz kann die 3-dimensionale TEE – oder Herztomographie räumliche Informationen liefern, die zur Optimierung der Implantationsstrategie und der Auswahl der Gerätegröße beitragen können.
Die Bedeutung von periprothetischen Lecks während der Nachbeobachtung bleibt ungewiss. Eine Subanalyse der PROTECT AF-Studie ergab keinen Zusammenhang zwischen Lecks und dem Auftreten klinischer Ereignisse., Im Gegensatz dazu wurde in Studien zu Ergebnissen der koronaren Herzchirurgie eine unvollständige LAA-Exzision bei Patienten mit chirurgischer prophylaktischer LAA-Okklusion mit einer höheren Rate kardioembolischer Ereignisse in Verbindung gebracht. Da wir darauf warten, dass neue Studien verfügbar werden, die diese Beziehung bestätigen oder nicht, sollten wir versuchen, periprosthetische Lecks zu verhindern. Daher wird empfohlen, dass das Gerät etwas größer sein sollte als TEE und angiographische Maßnahmen vermuten lassen, da dies es ermöglicht, die Rate der Restlecks zu reduzieren, ohne das Risiko eines LAA-Wandbruchs zu erhöhen.,13
Postprocedurale antithrombotische Empfehlungen sind ein weiteres kontroverses Thema. In der PROTECT AF-Studie wurden OAC für 45 Tage nach der Transplantation verabreicht und ausgesetzt, wenn das TEE eine adäquate LAA-Okklusion zeigte.12 Kürzlich zeigte die ASAP-Studie, dass eine 45-tägige OAC-Behandlung die doppelte thrombozytenaggregationshemmende Therapie ersetzen kann (100 mg Acetylsalicylsäure/Tag und 75 mg Clopidogrel/Tag).14 Derzeit empfehlen die meisten Zentren eine duale Thrombozytenaggregationshemmung für 1 bis 3 Monate und eine unbestimmte Thrombozytenaggregationshemmung., Gerätethrombose ist eine seltene Komplikation, wurde jedoch sowohl in Watchman™ – als auch in ACP-Geräten beschrieben. Obwohl diese Komplikation bei den meisten Patienten durch eine zweiwöchige Antikoagulationstherapie behoben wird, ist das potenzielle Risiko einer Embolie aufgrund einer Thrombusmigration eine der am meisten gefürchteten Komplikationen., In der einzigen berichteten spanischen Serie wurde bei 14% der Patienten eine alarmierende Thrombosegeschwindigkeit beobachtet, im Gegensatz zu 15 Dieser Unterschied im Thromboseprozentsatz könnte auf einen Unterschied in der Nachweisempfindlichkeit zurückzuführen sein: Im spanischen Register war das TEE-Folgeprotokoll viel länger (24 h und 1, 3, 6 und 12 Monate) als in den meisten untersuchten Zentren, in denen TEE für 3 bis 6 Monate verwendet wurde.,15 Da die meisten Fälle von Thrombose nach =3 Monaten auftraten und alle durch Verabreichung von Natriumheparin oder Enoxaparin für 2 Wochen gelöst wurden, könnte die Bestimmung der Durchführbarkeit einer 3-monatigen Antikoagulationstherapie oder einer umfassenderen Nachsorge eine zukünftige Option sein, sobald die wahre Inzidenz einer Thrombose geklärt ist. In jedem Fall ist eine multidisziplinäre, individuelle Beurteilung bei Patienten dieser Art erforderlich, die manchmal ein so hohes Blutungsrisiko aufweisen, dass selbst kurze Zeiträume einer Antikoagulationstherapie kontraindiziert sein können.,
SCHLUSSFOLGERUNGEN UND PERSPEKTIVEN FÜR DIE ZUKUNFT
Obwohl NVAF bereits eine der häufigsten Krankheiten in unserer Gesellschaft ist, wird seine Prävalenz in den kommenden Jahren aufgrund der fortschreitenden Alterung der Bevölkerung zunehmen. Aus verschiedenen Gründen nehmen zwischen 30% und 50% der für OAC angegebenen Patienten sie nicht ein. Heute ist die LAA-Okklusion eine Alternative für Patienten mit NVAF und Kontraindikationen für die Antikoagulationstherapie., Die LAA-Okklusion ist ein effizientes und sicheres Verfahren, erfordert jedoch ein Team mit Erfahrung in der strukturellen interventionellen Kardiologie und ist mit einer erheblichen Lernkurve für den Bediener verbunden.
In Zukunft könnte die LAA-Okklusion eine Alternative zur OAC-Behandlung für alle Patienten mit NVAF sein. Obwohl die PROTECT AF-Studie bereits bewiesen hat, dass die Wirksamkeit der LAA-Okklusion nicht geringer ist als die der Antikoagulationstherapie, weist die anfängliche Lernkurve eine hohe periprocedurale Komplikationsrate auf., Zwei neue randomisierte Studien-PREVAIL und ACP—werden die LAA-Okklusion spezifisch mit der OAC-Behandlung bei Patienten mit NVAF vergleichen, sobald die anfängliche Verfahrenslernkurve überwunden ist. Die PREVAIL-Studie vergleicht das Watchman™ – Gerät mit Warfarin und ACP das ACP-Gerät mit Warfarin und Dabigatran. Wenn die Ergebnisse beider Studien zeigen, dass die LAA-Okklusion nicht weniger erfolgreich ist als die Antikoagulationstherapie bei Patienten mit NVAF, könnte die Anwendung des Verfahrens verlängert werden und es könnte eine Alternative zur Antikoagulationstherapie für Patienten mit einem niedrigeren Risikoprofil werden.,
INTERESSENKONFLIKTE
Xavier Freixa ist Proctor von St. Jude Medical.