Atome und Lichtenergie
Die Untersuchung von Atomen und ihren Eigenschaften überlappt mehrere verschiedenewissenschaften. Chemiker, Physiker und Astronomen müssen alle den makroskopischen Maßstab verstehen, in dem ein Großteil des Universums funktioniert, um das „größere Bild“zu sehen.,
Innerhalb des Atoms
| Der Grundzustand eines Elektrons, das Energieniveau, das es normalerweise einnimmt, ist der Zustand der niedrigsten Energie für dieses Elektron. |
| Es gibt auch eine maximale Energie, die jedes Elektron canhave und immer noch Teil seiner atom. Darüber hinaus ist das Elektron nicht mehr an den Kern des Atoms gebunden und gilt als ionisiert., | 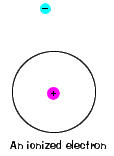 |
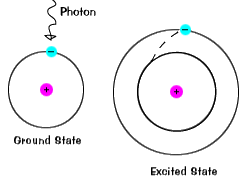 |
Wenn ein Elektron vorübergehend einen Energiezustand einnimmt, der größer als sein Grundzustand ist, befindet es sich in einem angeregten Zustand. state.An elektron kann angeregt werden, wenn ihm zusätzliche Energie gegeben wird, z. B. wenn es ein Photon oder ein Lichtpaket absorbiert oder mit einem nahe gelegenen Atom oder Teilchen kollidiert. |
Lichtenergie
Die Abbildungen auf dieser Seite sind natürlich vereinfachte Versionen realer Atome. Echte Atome, selbst relativ einfache wie Wasserstoff,haben viele verschiedene Orbitale, und so gibt es viele mögliche Energiemit unterschiedlichen Anfangs-und Endzuständen., Wenn sich ein Atom in einem erregten Zustand befindetzustand, Das Elektron kann auf einmal den ganzen Weg in den Grundzustand fallen, oder auf dem Weg in einer Zwischenebene anhalten.
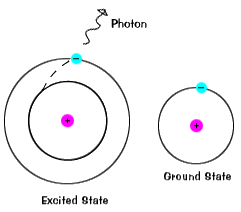 |
Elektronen bleiben nicht sehr lange in angeregten Zuständen – sie kehren bald zu ihren Grundzuständen zurück und emittieren ein Photon mit der gleichen Energie wie das, das absorbiert wurde., |
Identifizierung einzelner Arten von Atomen
Die Übergänge zwischen den verschiedenen Orbitalen sind für jedes Element eindeutig, da Dieenergieniveaus werden eindeutig durch die Protonen und Neutronen im Kern bestimmt. Wir wissen, dass verschiedene Elemente eine unterschiedliche Anzahl Vonprotonen und Neutronen in ihren Kernen haben. Wanndie Elektronen eines bestimmten Atoms kehren zu niedrigeren Orbitalenaus angeregten Zuständen haben die Photonen, die sie emittieren, Energien, die für diese Art von Atom charakteristisch sind., Dies gibt eachelement einen einzigartigen Fingerabdruck, so dass es möglich ist, die in einem Gasbehälter oder sogar einem Stern vorhandenen Elemente zu identifizieren.
Wir können Werkzeuge wie das Periodensystem der Elemente verwenden, um genau herauszufinden, wie viele Protonen und damit Elektronen ein Atom hat. Zuallererst wissen wirdass ein Atom, um eine neutrale Ladung zu haben, die gleiche Anzahl von Protonen und Elektronen haben muss. Wenn ein Atom Elektronen verliert oder gewinnt, wird es ionisiert oder geladen. Das Periodensystem gibt uns die Ordnungszahl vonein Element. Die Ordnungszahl sagt uns, wie viele Protonen ein Atom hat., Zum Beispiel hat Wasserstoff eine Ordnungszahl von eins – was bedeutet, dass er hatein Proton und damit ein Elektron – und hat tatsächlich keine Neutronen.
Zeichnen Sie für den Schüler
Zeichnen Sie basierend auf der vorherigen Beschreibung des Atoms ein Modell des Wasserstoffatoms. Das „Standard“ – Modell eines Atoms ist bekanntals das Bohr-Modell.
Verschiedene Formen desselben chemischen Elements, die sich nur durch die Anzahl der Neutronen in ihrem Kern unterscheiden, werden Isotope genannt. Die meisten Elemente haben mehr als ein natürlich vorkommendes Isotop., Viele weitere Isotope wurden in Kernreaktoren und wissenschaftlichen Laboratorien hergestellt. Isotope sind normalerweise nicht sehr stabil, und sie neigen dazu, radioaktiven Zerfall zu erleiden, bis etwas Stabileres entsteht. Sie können mit dem Elementuran vertraut sein – es hat mehrere instabile Isotope, U-235 ist einer der am meisten bekannten. Die 235 bedeutet, dass diese Form von Uran 235 Neutronen hatund Protonen kombiniert. Wenn wir Urans Ordnungszahl nachschlagen und subtrahieren, dass von 235, könnten wir die Anzahl der Neutronen berechnen, die Isotop hat.,
Hier ist ein weiteres Beispiel-Kohlenstoff tritt normalerweise in Form von C-12 (Kohlenstoff-12) auf, dh 6 Protonen und 6 Neutronen, obwohl ein Isotop C-13 ist, mit 6protonen und 7 Neutronen.
Für den Schüler
Verwenden Sie das Periodensystem und die Namen der unten angegebenen Elemente, um herauszufinden, wie viele Protonen, Neutronen und Elektronen sie haben.Zeichnen Sie ein Modell eines Atoms des folgenden Elements: Silizium-28, Magnesium-24, Schwefel-32, Sauerstoff-16 und Helium-4.,
Definieren Sie für den Schüler
Definieren Sie anhand des Textes die folgenden Begriffe: Energieniveaus, Absorption, Emission, angeregter Zustand, Grundzustand, Ionisation, Atom,Element, Atommasse, Ordnungszahl, Isotop.
Ein Optionaler Hinweis auf den Quantenmechanischen Natur der AtomeWährend das Bohr-atom oben beschrieben, ist ein schöner wayto erfahren Sie mehr über die Struktur von Atomen, es ist nicht der Genaueste Weg, tomodel Sie., Obwohl jedes Orbital eine genaue Energie hat, wird das Elektron jetzt als in einer „Elektronenwolke“um den Kern herum verschmiert angesehen. Es ist üblich, von der mittleren Entfernung zu thecloud als Radius des Elektrons zu sprechen orbit.So denken Sie daran, wir werden die Wörter „Orbit“ und „Orbital“ behalten, obwohl wir sie nicht verwenden, um keine flache Orbitalebene zu beschreiben, sondern Aregion, wo ein Elektron eine Wahrscheinlichkeit hat zu sein. Elektronen werden in der Nähe von thenucleus durch die elektrische Anziehung zwischen dem Kern und den Elektronen gehalten.,Dort bleiben die neun Planeten in der Nähe der Sonne, statt in der Galaxie. Im Gegensatz zum Sonnensystem, wo alle Umlaufbahnen der Planetensind auf der gleichen Ebene, Elektronen Umlaufbahnen sind dreidimensionaler. Jedes Energieniveau auf einem Atom hat eine andere Form. Es gibt mathematische Gleichungen, die Ihnen die Wahrscheinlichkeit des Orts des Elektrons in dieser Umlaufbahn mitteilen. Betrachten wir Diehydrogenatom, von dem wir bereits ein Bohr-Modell gezeichnet haben.,
Der Text und die Bilder in diesem Abschnitt wurden von Dave Slavens Seite aufdas Atom angepasst (siehe Referenzen unten). |

